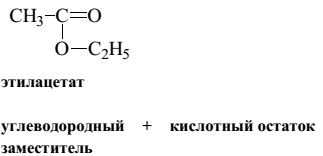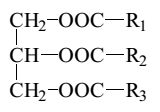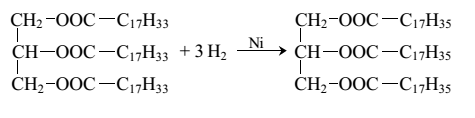Краткий конспект подготовки к ЗНО по химии № 44 Решение задач по уравнению реакции
Задача 1.
Условие задачи. При взаимодействии 6 л азота и 12 л водорода (н.у.) выделилось 2 л аммиака. Найдите выход аммиака от теоретически возможного.
Решение: Объёмы газов относятся как небольшие целые числа.

Водород находится в недостатке, вести расчёты будем относительно водорода. С 12л  должно было образоваться 8л
должно было образоваться 8л  .
.
Находим теоретический выход
η=
Правильный ответ: 25%.
Задача2.
Условие задачи. На сгорание 1м3 газа расходуется 3м3 кислорода. При этом образуется 2м3 водяных паров и 2м3 углекислого газа. Укажите молярную массу исходного газа.
Решение:

1м3 3м3 2м3 2м3
Из уравнения реакции видно, что весь кислород, содержащийся в воде и углекислом газе, берется из молекулярного кислорода, использующегося для окисления.
Соответственно других элементов, кроме углерода и водорода в исходном газе нет. Значит это углеводород.
х = 2; у = 4, это этилен  .
. = 28г/моль.
= 28г/моль.
Правильный ответ: 28г/моль.
Задача 3.
Условие задачи. Укажите число возможных реакций, протекающих с образованием водорода, которые можно провести между следующими веществами.
1. Раствор серной кислоты
2. Магний
3. Ртуть
4. Азотная кислота
5. Оксид магния
Комментарий:
Для решения задач о возможности взаимодействия вещества с несколькими веществами удобно делать таблицу:
 |
 |
 |
 |
 |
|
 |
-------- |  ↑ ↑ |
Х | Х |  |
 |
 ↑ ↑ |
-------- | Х | Водород не выделяется | Х |
 |
Х | Х | -------- | Водород не выделяется | Х |
 |
Х | Водород не выделяется | Водород не выделяется | -------- |  |
 |
 |
Х | Х |  |
-------- |
Вещество не реагирует само с собой, поэтому по диагонали ставим прочерки.
Металлы и оксид магния не будут взаимодействовать между собой с образованием водорода. Обе кислоты будут взаимодействовать с основным оксидом  , но будет образовываться соль и вода. Азотная кислота любой концентрации является окислителем не за счет
, но будет образовываться соль и вода. Азотная кислота любой концентрации является окислителем не за счет  , а за счет
, а за счет  , поэтому при взаимодействии с металлами водород не выделится. Разбавленная серная кислота с
, поэтому при взаимодействии с металлами водород не выделится. Разбавленная серная кислота с  не взаимодействует, так как
не взаимодействует, так как  стоит в ряду активности металлов после водорода, а с
стоит в ряду активности металлов после водорода, а с  выделяется водород.
выделяется водород.
Правильный ответ: одна реакция.
Задача 4.
Условие задачи. Смесь меди и оксида меди(II) массой 38,4 г растворили в концентрированной серной кислоте. При этом выделился оксид серы (IV) объёмом 6,72 л (н.у.). Определите массовую долю оксида меди в смеси (в%).
Решение: ↑
↑ 

 моль
моль (г)
(г)

Правильный ответ: 50%
Задача 5.
Условие задачи. Над разогретым порошком (Х1) пропустили водород. Полученное вещество красного цвета (Х2) растворили в концентрированной серной кислоте. Полученный раствор вещества голубого цвета (Х3) нейтрализовали раствором щелочи  , выпал голубой осадок (Х4), который при нагревании превратился в черный порошок (Х1).Укажите молярную массу исходного и полученного вещества.
, выпал голубой осадок (Х4), который при нагревании превратился в черный порошок (Х1).Укажите молярную массу исходного и полученного вещества.
Решение:
Сульфат металла голубого цвета – это  (X3). Значит все вещества – это соединения меди.
(X3). Значит все вещества – это соединения меди. ↓
↓ 
 ↓=
↓=
 ,
,
отсюда следует, что исходное вещество это  .
. г/моль
г/моль
Правильный ответ:  г/моль
г/моль
Задача 6.
Условие задачи. Из железной руды, содержащей 320 кг  , выплавили 134,4 кг железа. Найдите выход железа в процентах от теоретически возможного.
, выплавили 134,4 кг железа. Найдите выход железа в процентах от теоретически возможного.
Решение:
В этой задаче не имеет значения каким образом было получено железо →
→  ;
;
Из 1 моль  можно получить 2 моль
можно получить 2 моль 
 кмоль
кмоль
 кг
кг
η=
Правильный ответ: 60%
Краткий конспект подготовки к ЗНО по химии № 43 Решение задач: выражение количественного состава раствора
Задача 1.
Условие задачи. Определить массовую долю растворенного вещества в растворе, полученном при смешивании 200 г раствора с массовой долей растворенного вещества 40% и 800мл воды.
Решение: В 200 г 40%-ного раствора содержится 200∙0,4=80 г соли. При смешивании 200 г раствора с 800 мл ( или граммами) воды ( плотность воды равна единице) образуется 1000 г раствора, но количество соли при разбавлении раствора не изменяется. Массовая доля растворенного вещества равна
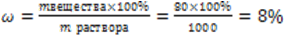
Правильный ответ: 8%.
Задача 2.
Условие задачи. Определить массовую долю растворенного вещества раствора, полученного при смешивании 200 г 10%-ного и 300г 40% растворов соляной кислоты.
Решение: При смешивании 200 г 10%-ного и 300г 40% растворов соляной кислоты образуется 500 г ( 200г+300г=500г) нового раствора, содержащего 20 г хлороводорода из 200г 10%-ного раствора( 200•0,1=20г) и 120 г хлороводорода из 300г 40% раствора ( 300∙0,4=120г). Значит, в 500 г раствора содержится 140 г (20г+120г=140г) хлороводорода. Массовая доля растворенного вещества равна
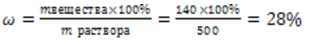
Правильный ответ: 28%.
Задача 3.
Условие задачи. Определить количество 10%-ного и 50%-ного растворов едкого калия, необходимых для приготовления 800г 25%-ного раствора.
Решение:
Воспользуемся правилом смешивания:
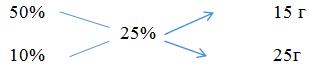
Из приведенной схемы видно, что для приготовления 40 г (15+25=40) 25%-ного раствора нужно взять 15 г 50%-ного и 25 г 10%-ного растворов. А для приготовления 800 г этого раствора  г 50%- ного и
г 50%- ного и  г 10% -ного растворов КОН.
г 10% -ного растворов КОН.
Правильный ответ: 300г 50% и 500г 10%.
Краткий конспект подготовки к ЗНО по химии № 42 Решение задач по химическим формулам
Моль. Молярная масса. Молярный объём
Задача 1.
Условие задачи. Сколько молекул содержится в молекулярном йоде массой 50,8 г?
Решение:
Молярная масса йода  равна 254 г/моль. Определяем количество вещества молекулярного йода. ,2 моль. Определить число молекул молекулярного йода, можно используя постоянную Авогадро
равна 254 г/моль. Определяем количество вещества молекулярного йода. ,2 моль. Определить число молекул молекулярного йода, можно используя постоянную Авогадро  1/моль. Следовательно,
1/моль. Следовательно,  моль
моль 1/моль.=
1/моль.= молекул.
молекул.
Правильный ответ:  молекул.
молекул.
Задача 2.
Условие задачи. Какой объём займет при нормальных условиях хлороводород массой 14,6г?
Решение:
Определяем количество вещества хлороводорода.
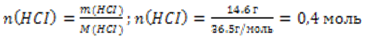
В соответствии с формулой
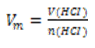
где  = 22,4 л/моль, объём хлороводорода при нормальных условиях составляет
= 22,4 л/моль, объём хлороводорода при нормальных условиях составляет
 = 22,4 л/моль∙0,4моль = 8,96 л.
= 22,4 л/моль∙0,4моль = 8,96 л.
Правильный ответ: = 8,96 л.
= 8,96 л.
Массовая доля
Задача 1.
Условие задачи. Рассчитайте массовую долю марганца в оксиде марганца (IV).
Решение:  = 87г/моль.
= 87г/моль.  = 55г/моль. Массовая доля элемента в веществе равна
= 55г/моль. Массовая доля элемента в веществе равна
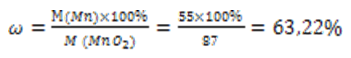
Правильный ответ: 63,22%
Относительная плотность газов
Задача 1.
Условие задачи. Определите плотности бромоводорода по водороду и по воздуху.
Решение: Для нахождения относительной плотности газов надо знать молярные массы газов.  = 81 г/моль,
= 81 г/моль,  = 2 г/моль. Воздух – это смесь газов (главным образом кислорода и азота). Зная объёмные доли газов в воздухе, можно рассчитать среднюю молекулярную массу. Она обычно принимается равной 29 г/моль.
= 2 г/моль. Воздух – это смесь газов (главным образом кислорода и азота). Зная объёмные доли газов в воздухе, можно рассчитать среднюю молекулярную массу. Она обычно принимается равной 29 г/моль.
Определяем относительную плотность бромоводорода по водороду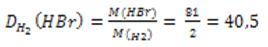
Определяем относительную плотность бромоводорода по воздуху.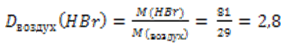
Правильный ответ:  = 40,5
= 40,5  воздух
воздух  = 2,8
= 2,8
Краткий конспект подготовки к ЗНО по химии № 41 Обобщение сведений об органических соединениях
Качественные, т.е. нерасчетные задачи можно условно разделить на несколько типов.
I. Задачи на объяснение фактов или тенденций
Задача 1.
Условие задачи. Согласно справочным данным, фенол представляет собой бесцветные прозрачные кристаллы. Тем не менее химический реактив фенол, стоящий в банке на полке, всегда окрашен в розовый цвет. Почему?

Решение.
Вспомним особенности строения фенола.
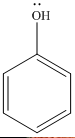
Поскольку – это бензольное кольцо, к которому присоединен атом заместителя кислорода, содержащего неподеленную электронную пару, то происходит взаимодействие электронов кислорода и бензольного кольца.
В результате происходит соряжение π-электронов бензольного кольца и электронной пары атома кислорода. Активность всего бензольного кольца сущетвенно возрастает. Получается вещество гораздо менне устойчиво к окислению по сранению с исходным бензолом.
Поэтому фенол всегда загрязнен продуктами окисления, имеющими яркую окраску. В результате, он имеет характерный розовый цвет.
II. Задачи на сравнение свойств веществ
Задача 1.
Условие задачи. Как изменятся свойства уксусной кислоты, при замене водородов в метильном радикале на атомы хлора:  →
→  →
→  →
→  ?
?
Решение.
При замещении водорода хлором, хлор как более электроотрицательный атом стягивает на себя электронную плотность.
Эта электронная плотность смещается от карбоксильной группы и соответственно от карбоксильного атома водорода  <
<  <
<  <
<
Атом водорода приобретает более положительный заряд. Уксусная кислота с заменой водорода на хлор в своем углеводородном радикале становится более легко диссоциирующей.
У нее становится более высокая константа диссоциации по сравнению с исходной уксусной кислотой. <
<  <СНCl2-СООН< СCl3-СООН
<СНCl2-СООН< СCl3-СООН
Трихлоруксусная кислота  уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
III. Задачи на качественный анализ органических соединений
Задача 1.
Условие задачи. Соединение А – легкокипящая жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода. Плотность паров одного из этих соединений В – лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди (II) в вещество С, которое используется для сохранения биологических препаратов.
Приведите возможные формулы веществ А, В, С.
Решение.
То, что могло быть окислено оксидом меди (II), является альдегидом. →
→ 
Делаем предположение: вещество С – альдегид. При этом данный альдегид используется для хранения биологических препаратов. Биологические препараты хранят в растворе формалина. Вещество – С – формальдегид (метаналь)  .
.
Формальдегид получился из метанола. Значит, вещество В – это метанол. →
→ 
Метанол  немного тяжелее воздуха.
немного тяжелее воздуха.  = 32 г/моль,
= 32 г/моль,  (воздуха) = 29 г/моль.
(воздуха) = 29 г/моль.
Поскольку при гидролизе исходного вещества получились два вещества с одинаковым числом атомов углерода  →
→  , то кислота с одним атомом углерода – это
, то кислота с одним атомом углерода – это  – муравьиная кислота.
– муравьиная кислота.
Исходное вещество А – с приятным запахом – это  – метиловый эфир муравьиной кислоты.
– метиловый эфир муравьиной кислоты.
Ответ: А -  ; В -
; В -  ; С – формальдегид
; С – формальдегид  .
.
IV. Задачи на различение веществ
Задача 1.
Условие задачи. В трех пробирках находятся три водных раствора: муравьиной кислоты НCOOH, соляной кислоты HCl и этанола C2H5-OH.Как, используя минимальное количество реактивов различить вещества в пробирках?
Решение.
1. Во все три пробирки добавляем индикатор, например, метилоранж. В растворах кислот, он изменит свой цвет на красный.
В оставшейся пробирке – этанол  .
.
2. Муравьиная кислота  является еще и альдегидом. Действуем на обе кислоты щелочным раствором
является еще и альдегидом. Действуем на обе кислоты щелочным раствором  .
. ↓
↓ →
→  ↓
↓  ↑
↑
 ↓ - осадок красного цвета.
↓ - осадок красного цвета.
3. В пробирке с соляной кислотой HCl синий осадок  ↓ просто растворится.
↓ просто растворится. ↓
↓ →
→  ↓
↓
Краткий конспект подготовки к ЗНО по химии №40 Синтетические высокомолекулярные соединения и полимерные материалы на их основе
Полимер – высокомолекулярное вещество, молекулы которого состоят из повторяющихся или сходных фрагментов, соединенных между собой химическими связями  .
.
Структурное звено – группы атомов, многократно повторяющиеся в молекуле полимера  .
.
Степень полимеризации – число структурных звеньев  в молекуле полимера
в молекуле полимера
Не все молекулы полимера имеют одинаковую длину и одинаковую массу, поэтому обычно говорят о среднем значении  и средней молярной массе полимера. Для разных полимеров степень полимеризации варьируется от нескольких сотен до нескольких тысяч, а молярная масса – от нескольких тысяч до миллионов г/моль.
и средней молярной массе полимера. Для разных полимеров степень полимеризации варьируется от нескольких сотен до нескольких тысяч, а молярная масса – от нескольких тысяч до миллионов г/моль.
Полимеризация
Полимеризация – последовательное присоединение молекул непредельных соединений друг к другу с образованием высокомолекулярного продукта.
Мономер – низкомолекулярное соединение, из которого получается цепь.
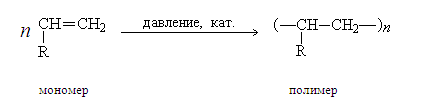
На концах молекулы полимера расположены какие-то другие группы, зависящие от того, с помощью каких катализаторов получен полимер. Масса концевых групп относительно массы всей молекулы полимера ничтожна, эти группы практически не влияют на свойства вещества, и в формуле полимера их не указывают.
При полимеризации молекулы могут соединяться между собой регулярно: «голова к хвосту» и «голова к голове», или нерегулярно, случайным образом.

Полиэтилен и полипропилен
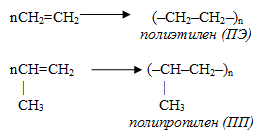
ПЭ и ПП легко плавятся, обладают химическими свойствами алканов. Они ни в чем не растворяются, поэтому их нельзя склеить никаким клеем. Чтобы соединить куски этих материалов, их сплавляют.
ПЭ и ПП используют как упаковочные материалы, из них готовят трубы, детали машин, изоляцию и т. д. 
ПЭ и ПП образуются из этилена и пропена при высоком давлении или при помощи катализаторов Циглера-Натта. ПЭ и ПП низкого давления, полученные с использованием катализаторов, имеют упорядоченную структуру. Их молекулы не содержат боковых ответвлений, а у ПП к тому же они регулярны. Кроме того, у них значительно выше средняя степень полимеризации.
Тефлон
Тефлон (политетрафторэтилен) – инертный и термостойкий полимер.
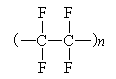
Из него делают детали приборов для химической промышленности, протезы для хирургии. В домашнем хозяйстве популярна посуда с тефлоновым покрытием.

Полиакрилонитрил
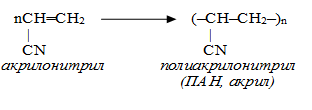
ПАН используется для изготовления искусственных волокон (в том числе искусственного меха), акриловых красок, накладных ногтей, пластиковой сантехники и т.п.

Поливинилхлорид
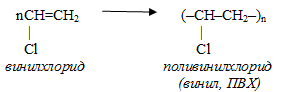
ПВХ используют для производства разнообразных емкостей, водопроводных труб, линолеума, «виниловых» моющихся обоев и т. д.

При горении ПВХ и ПАН образуются такие ядовитые газы, как хлороводород  , фосген
, фосген  , циановодород
, циановодород  и дициан
и дициан  .
.
Полистирол
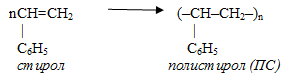
Нерегулярным макромолекулам ПС, содержащим объемные заместители, трудно упаковаться в упорядоченные кристаллические структуры, поэтому ПС хрупок, легко плавится, растворим во многих органических растворителях.
Из ПС делают коробочки для компакт-дисков, корпуса для шариковых ручек, детские игрушки, бытовую одноразовую посуду и т.д.

Влияние полимеров на экологию
В природе обычная бумага разлагается за 3-4 месяца, а изделия из полимеров могут сохраняться годами и даже десятилетиями. Одним из направлений в химии полимеров, является создание полимеров, способных разлагаться в природе или биоразлагаемых полимеров. Ведутся работы на разработку методов вторичного использования традиционных полимеров. Но для этого нужно научиться их правильно собирать. Несмотря на все усилия, в природе еще много изделий из полимеров, которые её загрязняют.
Природные полиизопрены
В натуральном каучуке содержится углеводород цис-полиизопрен  . Он является стереорегулярным полимером. Молекула может содержать 20-40 тыс. элементарных звеньев.
. Он является стереорегулярным полимером. Молекула может содержать 20-40 тыс. элементарных звеньев.
Натуральный каучук нерастворим в воде, зато хорошо растворяется в большинстве органических растворителей. Молекулы каучука закручены в клубки. При нагрузках они вытягиваются, при снятии нагрузки сворачиваются обратно. Т.е. каучук может подвергаться обратимой деформации (обладает эластичностью).
При нагревании каучук из эластичного состояния переходит в вязко текучее. Силы взаимодействия между молекулами ослабевают, полимер не сохраняет свою форму. Он напоминает очень вязкую жидкость. При охлаждении каучук из эластичного переходит в стеклообразное состояние, становится похож на твердое тело. Такой полимер, если приложить нагрузку, сразу порвется. Полимеры в стеклообразном состоянии могут быть хрупкими, их можно сломать или даже разбить. Поэтому каучук можно использовать лишь в узком температурном интервале.
Природный геометрический изомер каучука – гуттаперча, транс-1,4-полиизопрен. Молекулы гуттаперчи не закручены в клубки, они вытянуты даже в отсутствие нагрузок. Поэтому гуттаперча обладает намного меньшей эластичностью.
Вулканизация каучука
Каучук нагревают с серой. При этом макромолекулы каучука «сшиваются» друг с другом серными мостиками. Из отдельных макромолекул каучука образуется единая трехмерная пространственная сетка.
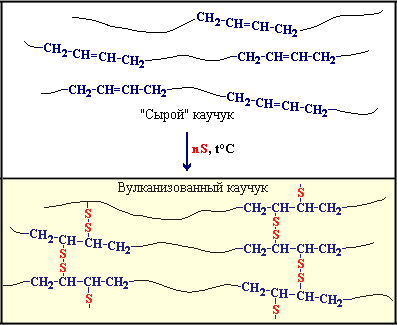
Изделие из полученного материала – резины – прочнее, чем из каучука, и оно сохраняет свою эластичность в широком интервале температур.
Синтетический каучук
Основателем первого в мире крупномасштабного производства синтетического каучука считается русский ученый С.В.Лебедев. Он впервые получил синтетический бутадиеновый каучук в 1910 г., промышленное производство началось в 1932 г.  →
→ 
Краткий конспект подготовки к ЗНО по химии №39 Белки
Белки – это природные полимеры, построенные из остатков аминокислот.
Гидролиз белков
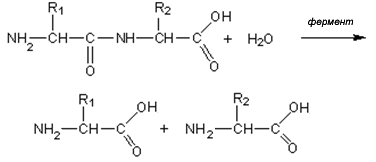
Пептидная связь гидролизуется в кислой или щелочной среде. При этом образуются соли аминокислот по карбоксильной группе или по аминогруппе.
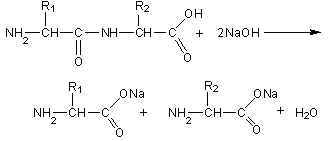
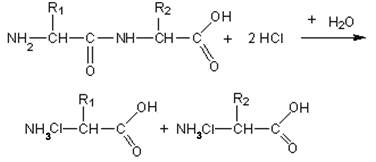
Белки гидролизуются и под действием ферментов
Функции белков в организме
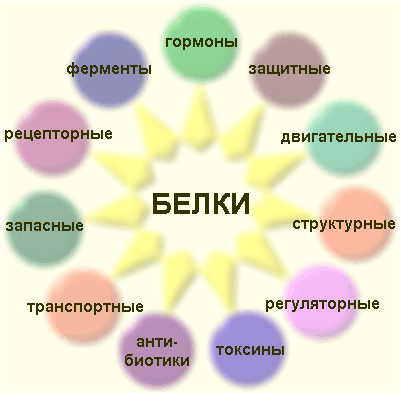
Функции белков в организме.
Строение белков
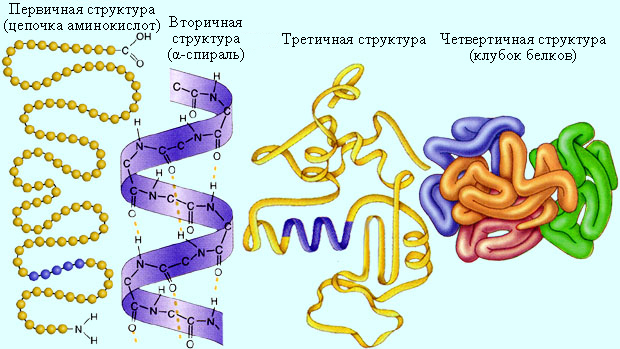
Первичная структура белка – это последовательность аминокислотных остатков.
Вторичная структура белка – расположение полипептидной цепи в пространстве, обусловленное водородными связями между атомом кислорода карбоксильной группы и атомом водорода аминогруппы разных аминокислотных остатков.
Третичная структура белка – расположение вторичной структуры в пространстве, обусловленное дополнительными взаимодействиями между различными участками полипептидной цепи.
Четвертичная структура белка – объединение нескольких полипептидных цепей в один белок.
Например, гемоглобин состоит из 4 пептидных цепочек, каждая из которых содержит по 140 остатков аминокислот.
Химические свойства белков
1. Денатурация белка
Денатурация – разрушение вторичной, третичной и четвертичной структуры белка при различных воздействиях (нагревании, действии растворителей, иногда даже при энергичном встряхивании). Первичная структура при этом не разрушается.
При снятии неблагоприятных воздействий наступает – ренатурация – восстановление до четвертичной структуры.
Деструкция – полное разрушение, затрагивающее даже первичную структуру.
Деструкция происходит при варке яйца, скисании молока.
2. Качественные реакции на белок
А. При нагревании белки разлагаются с выделением летучих продуктов, издавая характерный запах жженых перьев.
Б. Ксантопротеиновая реакция – пожелтение белка при действии концентрированной азотной кислоты (окраска появляется за счет нитрования бензольных колец, входящих в состав остатков ароматических аминокислот).
В. Биуретовая реакция – окрашивание в ярко-фиолетовый цвет при действии раствора соли меди(II) в щелочной среде – обусловлена образованием комплексов иона меди(II) с боковыми аминогруппами.
Краткий конспект подготовки к ЗНО по химии №38 Аминокислоты
Аминокислоты – это органические соединения, молекулы которых содержат и карбоксильную группу  , и аминогруппу
, и аминогруппу  .
.
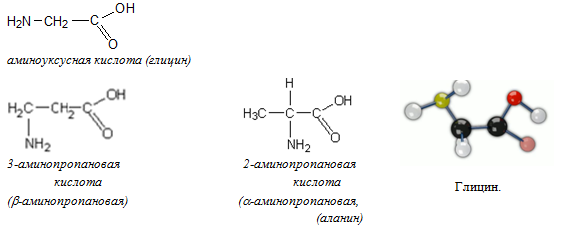
В состав белков входят только аминокислоты, в которых аминогруппа и карбоксильная группа находятся у одного и того же атома углерода (α-аминокислоты).
Общая формула природных аминокислот
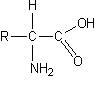
Примеры некоторых природных α-аминокислот
| Глицин |  |
Gly |
| Аланин |  |
Ala |
| Аспарагиновая кислота |  |
Asp |
| Цистеин |  |
Cys |
| Лизин |  |
Lys |
| Тирозин |  |
Tyr |
| Глутаминовая кислота |  |
Glu |
Обратите внимание, что молекулы природных аминокислот могут включать и другие функциональные группы.
Амфотерность аминокислот
Амфотерность – это способность одного вещества проявлять как кислотные, так и основные свойства.
В молекуле аминокислоты присутствуют одновременно оснóвная группа (аминогруппа) и кислотная группа (карбоксильная группа). Эти группы взаимодействуют друг с другом, как кислота с основанием, и образуется внутренняя соль:

Поэтому аминокислоты похожи по физическим свойствам на соли: это твердые, кристаллические вещества, растворимые в воде. Среда растворов нейтральная.
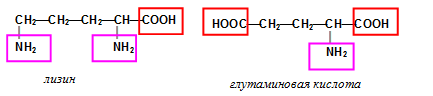
Все ли аминокислоты нейтральны? Строго говоря, нет. Например, раствор лизина имеет основную среду, а раствор глутаминовой кислоты – кислотную:
Будучи амфотерными, аминокислоты могут взаимодействовать и с кислотами, и с основаниями с образованием солей:
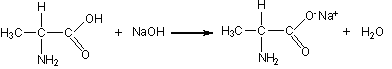
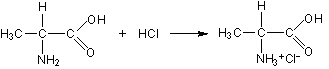
Образование пептидов
Пептидная связь – полярная ковалентная связь между атомом углерода группы  и атомом азота группы
и атомом азота группы  двух разных α-аминокислот.
двух разных α-аминокислот.
Пептид – вещество, состоящее из остатков α-аминокислот, соединенных пептидными связями.
В определенных условиях от аминогруппы одной молекулы и карбоксильной группы другой молекулы отщепляется молекула воды, и два остатка аминокислот соединяются пептидной связью:
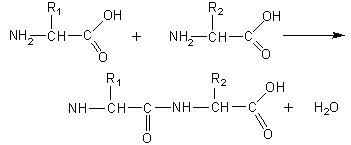
На концах получившейся молекулы (дипептида) – свободные аминогруппа и карбоксильная группа. Они могут реагировать с другими аминокислотами, образуя трипептиды, тетрапептиды… полипептиды.
Дипептид – вещество, состоящее из остатков двух аминокислот, соединенных пептидными связями.
Полипептид – полимер, состоящий из остатков аминокислот, соединенных пептидными связями.
В общем случае (не только для α-аминокислот) связь, которой соединены остатки аминокислот, носит название амидной связи. Синтетические аминокислоты применяют в промышленности для получения полиамидов, идущих на изготовление волокон и тканей. Например, всем известный полимер капрон образован из ε-аминокапроновой кислоты  :
:
Получение аминокислот.
1. Гидролиз белков
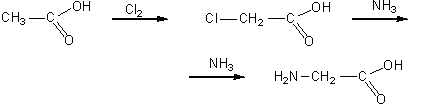
2. Получение глицина:
Краткий конспект подготовки к ЗНО по химии №37 Амины
Амины – это органические соединения, в состав которых входит трехвалентный атом азота. Амины можно представить как органические производные аммиака.
Аминогруппа – функциональная группа аминов. Состоит из трехвалентного атома азота и связанных с ним атомов водорода. Например:  .
.
Классификация аминов
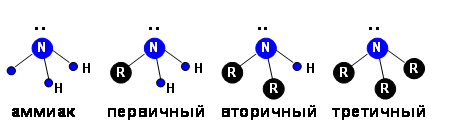
Первичный амин – это амин, в котором атом азота образует одну связь с углеводородным радикалом и две с атомами водорода.
Вторичный амин – это амин, в котором атом азота образует две связи с углеводородными радикалами и одну с атомом водорода.
Третичный амин – это амин, в котором атом азота образует три связи с углеводородными радикалами.
Существуют циклические амины. Например:
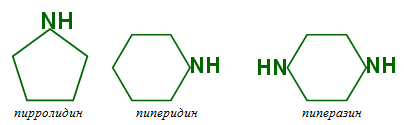
пирролидин пиперидин пиперазин
Подобно многоатомным спиртам, существуют и амины, имеющие несколько аминогрупп: этилендиамин
этилендиамин кадаверин
кадаверин спермин
спермин
Номенклатура аминов
Для построения названий первичных аминов используется суффикс «амин» (или приставка «амино»). метанамин
метанамин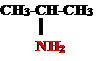 пропанамин-2
пропанамин-2 гександиамин-1,6
гександиамин-1,6
Эта номенклатура неудобна для вторичных и третичных аминов. Их названия строятся, исходя из корня “амин”. К нему присоединяются приставки, обозначающие радикалы. Они перечисляются в алфавитном порядке. Первичные амины также можно называть таким образом. метилэтиламин
метилэтиламин диметиламин
диметиламин метиламин
метиламин
Изомерия аминов
1. Скелетная изомерия:
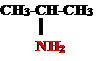 пропанамин-2, изопропиламин
пропанамин-2, изопропиламин пропанамин-1, н-пропиламин
пропанамин-1, н-пропиламин
2. Изомерия положения и взаимного положения аминогрупп: бутандиамин-1,4, путресцин
бутандиамин-1,4, путресцин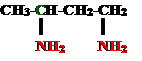 бутандиамин-1,3, изопутресцин
бутандиамин-1,3, изопутресцин
3. Оптическая изомерия:
В молекуле изопутресцина (см. выше) есть асимметрический атом углерода. Он выделен зеленым цветом и отвечает за существование двух разных оптических изомеров этого соединения.
Изомерия, связанная с перераспределением атомов углерода между углеводородными радикалами: н-пропиламин
н-пропиламин метилэтиламин
метилэтиламин триметиламин
триметиламин
Физические свойства аминов
Амины имеют резкий запах, с одной стороны, похожий на запах аммиака, а с другой – на запах гниющей рыбы.
Полярность связи  и наличие водородных связей:
и наличие водородных связей:
1. Большинство аминов – жидкости (только метиламин, этиламин, диметиламин и триметиламин – газы).
2. Хорошая растворимость в воде.
Растворимость третичных аминов меньше, чем вторичных и первичных, потому что у третичных аминов отсутствуют атомы водорода при атоме азот, нет сильно полярной связи  .
.
Амины с большими углеводородными радикалами растворяются плохо, потому что малополярные фрагменты алканов гидрофобны.
Химические свойства аминов
Амины сходны по строению с аммиаком и с алканами. Поэтому они проявляют схожие свойства. Но аминогруппа влияет на углеводородный радикал, а он – на аминогруппу.
Горение аминов.
Амины загораются на воздухе легче, чем аммиак. ;
; .
.
Основные свойства.
Первичные, вторичные и третичные амины обязательно содержат неподеленную электронную пару, как и полагается трехвалентному азоту. То есть амины в растворе проявляют основные свойства или их растворы являются основаниями.
Подобно аммиаку, амины проявляют свойства оснований: ;
; .
.
С кислотами аммиак образует соли аммония, а амины – алкиламмония: (бромид аммония)
(бромид аммония) (бромид этиламмония)
(бромид этиламмония)
Анилин
Простейший представитель класса ароматических аминов – анилин. Это маслянистая жидкость, немного растворимая в воде.
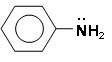
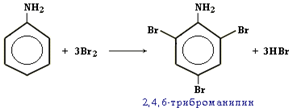
Анилин реагирует с бромной водой, при этом сразу образуется
2,4,6-триброманилин – белый осадок (качественная реакция на анилин и другие амин бензолы).
Вспомним: бензол взаимодействует с бромом только в присутствии катализатора.
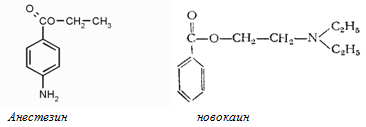
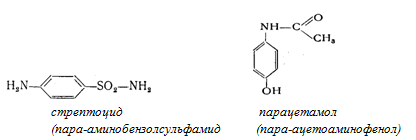
Применение анилина и аминов
Из продуктов окисления анилина получают анилиновые красители, отличающиеся стойкостью и яркостью.
Из анилина и аминов получают применяемые для местного наркоза анестезин и новокаин; противобактериальное средство стрептоцид; популярное обезболивающее и жаропонижающее средство парацетамол:
Анилин и амины – сырье для производства пластмасс, фотореактивов, взрывчатых веществ. Взрывчатое вещество гексил (гексанитродифениламин):
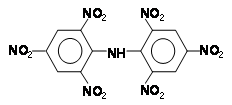
Получение анилина и аминов
1. Нагревание галогеналканов с аммиаком или менее замещенными аминами (реакция Гофмана). (правильнее
(правильнее  );
);
2. Вытеснение аминов из их солей нагреванием со щелочами: .
.
3. Восстановление нитро соединений (реакция Зинина): ;
;
Краткий конспект подготовки к ЗНО по химии №36 Повторение кислородсодержащих органических соединений
Органические соединения подразделяют по составу на:
1. углеводороды – вещества, состоящие только из углерода и водорода;
2. кислородсодержащие органические соединения, в состав которых входят атомы углерода, водорода и кислорода;
3. азотсодержащие органические соединения – содержат, кроме атомов углерода, водорода (и иногда кислорода) еще и атом азота.
Однако при этом в одну группу кислородсодержащих соединений попадают вещества с очень разными свойствами, такие, например, как уксусная кислота, сахар и целлюлоза.
Классификация по строению
Наиболее полезна для химиков классификация органических веществ по их строению. Внутри этой классификации существуют признаки, позволяющие наиболее полно охарактеризовать вещества.
1. Первый признак классификации органического соединения по строению – тип скелета молекулы.
Скелет – это последовательность связанных атомов углерода в молекуле, основа структуры органического соединения.
Кроме атомов углерода, в состав скелета могут входить и другие атомы, например,  если они связаны, по меньшей мере, с двумя атомами углерода.
если они связаны, по меньшей мере, с двумя атомами углерода.
Например, в диметиловом эфире  атом кислорода включен в скелет молекулы, а в этаноле
атом кислорода включен в скелет молекулы, а в этаноле  – нет. Молекулы, в скелет которых, кроме атомов углерода, входят атомы других элементов, называются гетероатомными («гетеро-» о – лат. «разный»).
– нет. Молекулы, в скелет которых, кроме атомов углерода, входят атомы других элементов, называются гетероатомными («гетеро-» о – лат. «разный»).
Скелет молекулы может быть неразветвленным – все атомы углерода соединены последовательно – и разветвленным. Цепь из атомов углерода может быть замкнутой. Такую замкнутую группу атомов называют циклом. Поэтому скелет молекулы бывает или ациклическим, (т.е. не циклическим) или циклическим. В скелете различают первичный, вторичный, третичный, четвертичный атомы углерода.
Первичным называют атом углерода, связанный только с одним другим атомом углерода, вторичным – с двумя, третичным – с тремя, а четвертичным – с четырьмя другими атомами углерода.

2. Второй признак классификации – наличие (или отсутствие) в молекуле кратных связей и бензольных колец. Органические вещества, содержащие только простые (одинарные) связи, называют предельными или насыщенными. Вещества, которые содержат не только простые, но и кратные (двойные или тройные) связи между атомами углерода, называют непредельными или ненасыщенными. На один атом углерода в их молекулах приходится меньшее число атомов водорода, чем у предельных соединений. Если вещество содержит бензольное кольцо, то его принято называть ароматическим соединением. Вещества, в состав которых не входят ароматические группировки, называют алифатическими. Иногда можно встретить устаревшее название алифатических соединений – соединения жирного ряда.
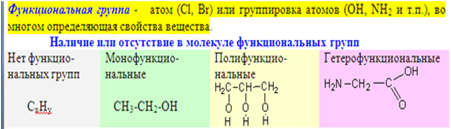
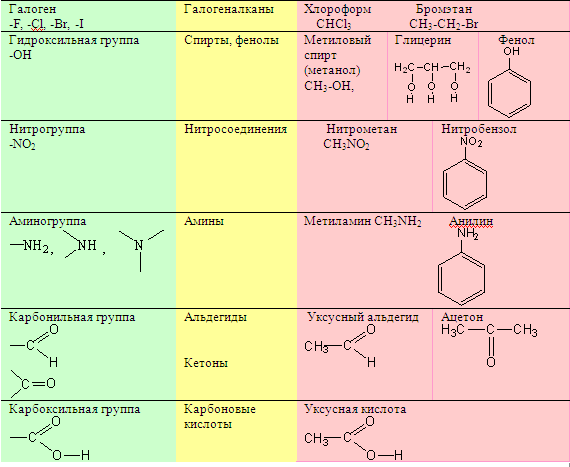
3. Третий признак классификации – наличие (или отсутствие) функциональных групп. Производные углеводородов образуются при замещении атома водорода на какой-либо другой атом  или группировку атомов (
или группировку атомов ( - гидроксогруппа,
- гидроксогруппа,  - аминогруппа и т.п.). Такие атом или группировка атомов во многом определяют свойства вещества, и поэтому многие из них называют функциональными группами. По числу функциональных групп в молекуле вещества делят на монофункциональные, полифункциональные (несколько одинаковых групп) и гетеро функциональные (разные функциональные группы).
- аминогруппа и т.п.). Такие атом или группировка атомов во многом определяют свойства вещества, и поэтому многие из них называют функциональными группами. По числу функциональных групп в молекуле вещества делят на монофункциональные, полифункциональные (несколько одинаковых групп) и гетеро функциональные (разные функциональные группы).
Вещества, обладающие одинаковыми функциональными группами и (или) одинаковым набором кратных связей, имеют сходные свойства, поэтому их относят к одному классу органических соединений. Например, вещества, содержащие  - группу, относятся к классу спиртов.
- группу, относятся к классу спиртов.  – метиловый спирт,
– метиловый спирт,  – этиловый спирт и т.д.
– этиловый спирт и т.д.
Вещества, содержащие кратные связи, тоже образуют классы близких по свойствам соединений. Соединения с двойной связью, называются алкенами, с тройной связью – алкинами. Предельные углеводороды, или алканы – это соединения, не содержащие ни кратных связей, ни функциональных групп. Они также составляют отдельный класс органических веществ. Ароматические углеводороды называют аренами.
Ряды веществ с похожими свойствами, состав которых отличается на одну или несколько групп  , называют гомологическими рядами. Члены гомологических рядов по отношению друг к другу – гомологи. По сути, гомологические ряды составляют классы органических соединений.
, называют гомологическими рядами. Члены гомологических рядов по отношению друг к другу – гомологи. По сути, гомологические ряды составляют классы органических соединений.
Краткий конспект подготовки к ЗНО по химии №35 Углеводы
Классификация и строение углеводов
Современные данные по строению позволили выяснить, что практически все углеводы содержат гидроксильные группы, а также карбонильные группы. Либо альдегидные, либо кетонные, т.е. углеводы являются либо полигидроксиальдегидами, либо полигидроксикетонами.
Полигидроксиальдегиды называют еще альдозами, например, глюкоза.
Полигидроксикетоны называют еще кетозами, например, фруктоза.
Кроме того, что в углеводы входят альдегидные и гидрокси группы, их еще классифицируют по способности к гидролизу, т.е. углеводы делят на три основных типа.
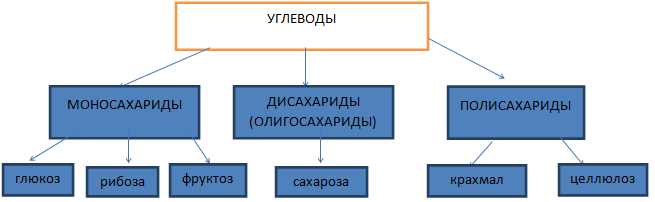
Те углеводы, которые гидролизу не подвергаются, т.е. в результате реакции с водой в присутствии кислотного катализатора не изменяются, называются моносахариды.
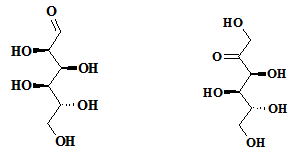
Типичные моносахариды – глюкоза и фруктоза.
Углеводы, которые при гидролизе распадаются на несколько моносахаридов, от 2 до 20, называют олигосахариды. Типичные олигосахариды – сахароза, которая при гидролизе превращается в смесь глюкозы и фруктозы.
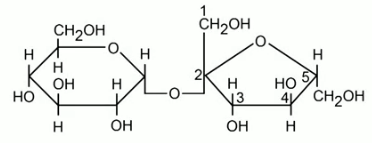 Сахароза
Сахароза
И, наконец, в природе очень распространены сложные полимерные образования, чаще всего на базе глюкозы. Они уже называются полисахаридами, поскольку при гидролизе такого полисахарида образуются от тысяч до десятков тысяч моносахаридов.
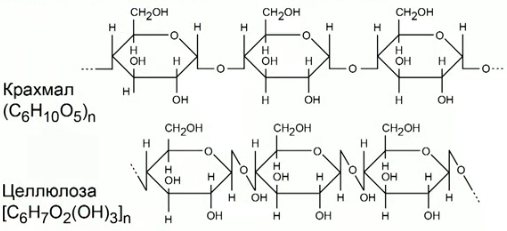
Например, самые распространенные природные полисахариды – это крахмал и целлюлоза, которые составляют основную массу очень многих растительных объектов.
Классификация моносахаридов
Сами моносахариды еще классифицируют по количеству атомов углеродов, входящих в одну молекулу.
Бывают трех углеродные моносахариды, 4, 5, 6.
Наиболее распространены в природе моносахариды с 5 атомами углерода, их называют пентозы. И с 6 атомами углерода, их называют гексозы. Наиболее известны нам гексозы. Это глюкоза и фруктоза. И в школьном курсе принято хорошо помнить название двух пентоз – рибоза и дезоксирибоза, которые входят в состав сложных молекул.
Химические свойства глюкозы
К химическим свойствам углеводов относятся те, которые связаны с их функциональными группами. Поскольку все углеводы содержат спиртовые группы, они, как и полагается спиртам образуют простые и сложные эфиры.
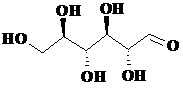
1. Образование эфиров.
2. С гидроксидом меди(II) образуется ярко-синее комплексное соединение глюконата меди.

3. Окисление глюкозы.
продуктами реакции являются глюконовая кислота C5H11O5COOH. Происходит изменение окраски из-за образования красного осадка оксида меди(I)  ↓.
↓.

• Реакция «серебряного зеркала». ↓
↓
• Восстановление глюкозы. (сорбит).
(сорбит).
Сорбит используется как заменитель сахара и глюкозы, поскольку он хуже усваивается организмом и не так вреден как избыток сахара. Его добавляют в жевательную резинку и в диетические продукты.
4. Биохимические реакции с участием глюкозы.
А. Спиртовое брожение глюкозы. ↑
↑
Этот процесс является основой выпечки дрожжевого хлеба.
Б. Молочнокислое брожение.
Образуется молочная кислота. Этот процесс происходит при скисании молока, при брожении капусты.
В. Маслянокислое брожение. ↑
↑  ↑
↑
Масляная кислота обладает неприятным запахом. Эти продукты называют сивушными маслами.
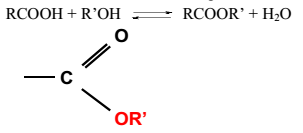
Краткий конспект подготовки к ЗНО по химии №34 Сложные эфиры. Жиры
Конспект 34. Сложные эфиры. Жиры
Сложные эфиры
В присутствии сильных неорганических кислот гидроксильная группа обратимо обменивается на остаток спирта:
Сложные эфиры RCOOR’ – производные карбоновых кислот, у которых гидроксил карбоксильной группы замещен на остаток спирта.
Номенклатура сложных эфиров
Названия по ИЮПАК выделены жирным цветом:
|
|
|
|
|
Этилформиат, этилметаноат; этиловый эфир муравьиной кислоты |
Метилацетат, метилэтаноат; метиловый эфир уксусной кислоты |
Этилбутират, этилбутаноат; этиловый эфир бутановой кислоты |
Физические свойства эфиров

Температуры кипения сложных эфиров меньше, чем температуры кипения кислот и спиртов с близкой молярной массой. Почему? Сложные эфиры, в отличие от кислот и спиртов, неспособны образовывать водородные связи между молекулами.
Химические свойства сложных эфиров
Главное химическое свойство сложных эфиров – способность к гидролизу: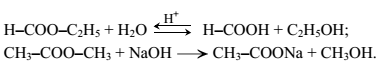
Жиры – сложные эфиры глицерина и жирных (неразветвленных одноосновных карбоновых) кислот.
Сложные эфиры RCOOR’ – производные карбоновых кислот, у которых гидроксил карбоксильной группы замещен на остаток спирта.
Жиры – строительный материал и запас энергии организма. В теле человека массой 70кг в среднем содержится около 11кг жира.
В животных жирах обычно содержатся остатки предельных (насыщенных) углеводородов. Эти жиры твердые.
Растительные жиры (масла) обычно жидкие при комнатной температуре. В состав растительных масел обычно входят остатки непредельных (ненасыщенных) кислот. Растительные масла жидкие потому, что окружение каждой двойной связи – жесткая плоская конструкция из 6 атомов, и такие молекулы плохо укладываются в кристаллическую решетку. …
…
Гидрирование жиров
Из дешевых сортов растительных масел, непригодных для употребления в пищу, получают с помощью неполного гидрирования маргарин, а при глубоком гидрировании образуется саломас – твердая масса, которую используют для производства мыла:
Гидролиз жиров
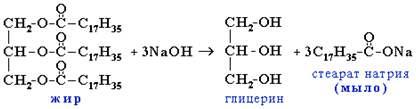
В организме под действием ферментов жиры разлагаются на глицерин и жирные кислоты:
В промышленности проводят щелочной гидролиз жиров, при этом образуется глицерин и смесь солей жирных кислот – мыло.
Краткий конспект подготовки к ЗНО по химии №32 Альдегиды
Конспект 32. Альдегиды
Классификация карбонильных соединений
Карбонильная группа – группа из атомов С и О, связанных двойной связью.
Карбонильные соединения делят на два класса – альдегиды и кетоны.
|
Альдегиды соединения, в которых карбонильная группа связана хотя бы с одним атомом водорода |
Кетоны соединения, в которых карбонильная группа связана только с атомами углерода |
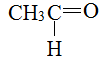 |
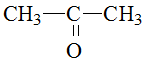 |
Первый член ряда альдегидов – формальдегид, или муравьиный альдегид, или метаналь. В его молекуле карбонильная группа связана только с атомами водорода:
Физические свойства и строение альдегидов и кетонов
Карбонильная группа полярна:
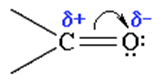
Следствия:
1. Альдегиды и кетоны с небольшим числом атомов углерода хорошо растворимы в полярных растворителях, например, в воде. При увеличении вклада углеводородного заместителя растворимость в воде падает.
2. Температуры плавления и кипения альдегидов и кетонов выше, чем у соответствующих алканов. Однако они ниже, чем у спиртов. Ведь в спиртах присутствует еще более полярная связь О-Н.
Обратите внимание! Поскольку ни в альдегидной, ни в кетонной группе нет связи между водородом и кислородом, между молекулами альдегидов и кетонов не возникает водородная связь.
Номенклатура альдегидов и кетонов
При образовании названий по ИЮПАК наличие альдегидной группы в молекуле обозначается суффиксом -аль, а кетонной – -он.
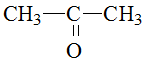

Пропанон бутаналь
Многие альдегиды и кетоны имеют тривиальные названия: формальдегид (муравьиный альдегид)
формальдегид (муравьиный альдегид)  ацетальдегид (уксусный альдегид)
ацетальдегид (уксусный альдегид)  пропионовый альдегид
пропионовый альдегид масляный альдегид
масляный альдегид валериановый альдегид
валериановый альдегид
Изомерия альдегидов и кетонов
Для кетонов с числом атомов углерода больше 4-х характерна изомерия положения функциональной группы:
 пентанон-2
пентанон-2 пентанон-3
пентанон-3
Химические свойства альдегидов
Нуклеофильное присоединение
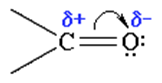
Атомы углерода и кислорода карбонильной группы связаны двойной связью. Из этого следует, что для этих веществ характерны реакции присоединения.
Восстановление.
Альдегиды и кетоны присоединяют водород при нагревании под давлением в присутствии катализатора: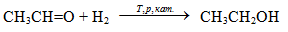
Окисление.
1. Реакция «серебряного зеркала».
При аккуратном нагревании альдегида в водно-аммиачном растворе оксида серебра стенки пробирки покрываются зеркальным слоем выделившегося серебра: ↓.
↓.
Более правильно писать:![RCH=O + 2[Ag(NH_3)_2]OH right RCOONH_4 + 2Ag RCH=O + 2[Ag(NH_3)_2]OH right RCOONH_4 + 2Ag](/plugins/content/MathPublisher/mathpublisher/img/math_962.5_55804dede2bf0aa9f525101e186ccb0d.png) ↓ +
↓ +  .
.
2. Взаимодействие с гидроксидом меди (II).
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску томатного сока – образуется красный осадок оксида меди (I): ↓+
↓+  .
.
Краткий конспект подготовки к ЗНО по химии №33 Карбоновые кислоты
Конспект 33. Карбоновые кислоты
Карбоновые кислоты часто называют просто органическими кислотами за их кислотные свойства. Свойства карбоновых кислот обусловлены наличием в них карбоксильной группы или карбоксила. Карбоксильная группа образована сочетанием двух групп:
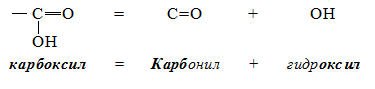
Карбоксильная группа – СООН – функциональная группа карбоновых кислот.
Номенклатура карбоновых кислот
Название кислот образуется так, что к названию предельного углеводорода прибавляется
-овая кислота.
Тривиальные названия важнейших кислот
Алифатические предельные одноосновные кислоты:
НСООН муравьиная уксусная
уксусная пропионовая
пропионовая
Непредельные кислоты: акриловая
акриловая олеиновая
олеиновая
Ароматические кислоты: бензойная
бензойная
Двухосновные кислоты: щавелевая
щавелевая малоновая
малоновая
Физические свойства карбоновых кислот
Водородные связи (прочнее, чем у молекул спиртов!)
1. температуры кипения и плавления карбоновых кислот намного выше, не только чем у соответствующих углеводородов, но и чем у спиртов;
2. хорошая растворимость в воде (с увеличением углеводородного радикала уменьшается).
Водородные связи в карбоновых кислотах настолько сильны, что эти вещества образуют димеры:
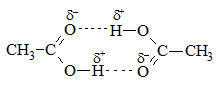
Химические свойства карбоновых кислот
1. Наличие свободного иона водорода в растворах кислот обуславливает их кислый вкус и взаимодействие с индикаторами.
2. Кислоты взаимодействуют с активными металлами, выделяя водород:
 →(СН3СOO)2Mg +
→(СН3СOO)2Mg +  .
.
этанат магния
(ацетат магния)
3. Реакции c основаниями: →
→ .
.
4. Реакции с основными оксидами: →
→ .
.
5. Реакции с солями более слабых кислот: →
→ ↓.
↓.
Муравьиная кислота
Это вещество можно рассматривать не только как кислоту, но и как альдегид. Коричневым цветом обведена альдегидная группа.
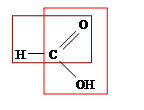
Поэтому муравьиная кислота проявляет типичные для альдегидов восстановительные свойства:
1. Реакция серебряного зеркала:
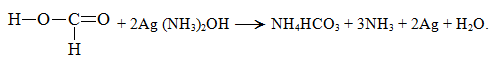
2. Реакция с гидроксидом меди при нагревании: ↓ +
↓ +  .
.
3. Окисление хлором до углекислого газа:
Концентрированная серная кислота отбирает у муравьиной кислоты воду. При этом образуется монооксид углерода: ↑.
↑.
Строение и свойства мыла
В промышленности проводят щелочной гидролиз жиров, при этом образуется глицерин и смесь солей жирных кислот – мыло:
Действие мыла.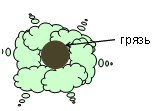 Почему растворы мыла растворяют частички грязи?
Почему растворы мыла растворяют частички грязи?
Потому что анион соли жирной кислоты состоит из двух частей: гидрофильной (полярный остаток карбоксильной группы, на котором сосредоточен отрицательный заряд) и гидрофобной (большой углеводородный радикал).
Гидрофильность – сродство к воде, способность к электростатическому взаимодействию с молекулами воды.
Гидрофобность – отсутствие сродства к воде, неспособность к электростатическому взаимодействию с молекулами воды, приводящие к выталкиванию из водной среды.
Углеводородные радикалы мыла прилипают к грязевой частице, а гидрофильная часть взаимодействует с водой. В результате грязь отрывается от поверхности и переходит в раствор, где другие анионы мыла окружают ее со всех сторон и не дают осесть обратно:
Краткий конспект подготовки к ЗНО по химии №30 Спирты
Конспект 30. Спирты
Спирты – производные углеводородов, в которых один или несколько атомов водорода заменены на функциональную группу –OH (гидроксил): R-OH метан →
метан →  метиловый спирт
метиловый спирт этан →
этан →  этиловый спирт
этиловый спирт
Название спирта образуется от названия предельного углеводорода с прибавлением окончания -ол. Например,  – метанол,
– метанол,  – этанол,
– этанол,
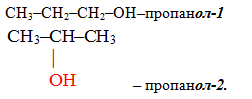
Выбор главной цепи:
1. Главная цепь включает гидроксил.
2. Главная цепь нумеруется так, чтобы атом углерода с гидроксилом получил наименьший номер.
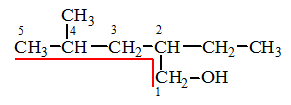
4-метил-2-этилпентанол-1
Одноатомный спирт – спирт, молекула которого содержит одну гидроксильную группу.
Пример: 
Многоатомный спирт – спирт, молекула которого содержит две или более гидроксильные группы.
Пример: 
Количество гидроксильных групп в молекуле отражается в названии частицами ди-, три-, тетра- и т. д., поставленными перед суффиксом -ол.
пропантриол-1,2,3 (глицерин).
Физические свойства спиртов
1. Температуры плавления и кипения спиртов, так же как и углеводородов, увеличиваются с ростом числа атомов углерода в молекуле, но их значения у спиртов намного больше, чем у соответствующих алканов.
Причина – водородные связи между молекулами спиртов:
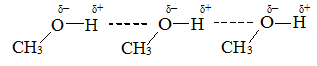
 2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях.
2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях.
С увеличением углеводородного радикала растворимость в воде постепенно уменьшается.
3. Низшие спирты обладают характерным запахом. Например, кошачий запах связан с тем, что в этот запах основным компонентом входит изопропиловый спирт.
Химические свойства спиртов
У всех спиртов есть одинаковый признак – это наличие гидроксильной группы. Эта гидроксогруппа делает спирты в какой-то степени подобной воде. Сходство строения Сходство строения спиртов и воды обусловливает сходство химических свойств, из-за гидроксильной группой – ОН.
Реакция со щелочными металлами:
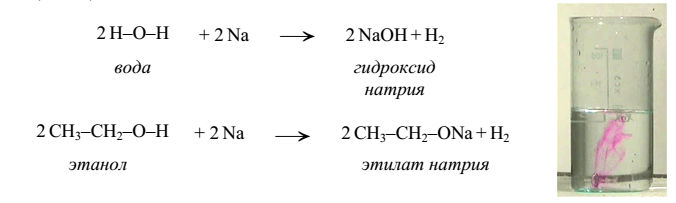
Спирт и вода в реакциях с натрием отдают ион водорода, т.е. в данной реакции они проявляют кислотные свойства. Продукт реакции спирта с натрием – соль.
Общее название солей спиртов – алкоголяты. Реакции спиртов со щелочными металлами довольно широко используется в лабораторной практике. Остатки щелочных металлов опасно уничтожать, вводя их в реакцию с водой, поскольку вода очень активно взаимодействует с ними. Поэтому чаще всего для этих целей используют этиловый спирт.
Реакция со щелочами:
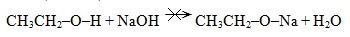
Реакция не идет!
Причина: спирт – более слабая кислота, чем вода, и не может вытеснить воду.
Многоатомные спирты
Многоатомные спирты – соединения, у которых две или несколько гидроксильных групп расположены у соседних атомов углерода.
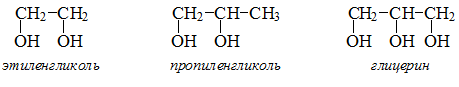
Свойства многоатомных спиртов
- 1. Общие свойства с другими спиртами:
Например, образование сложных эфиров при взаимодействии с кислотами:
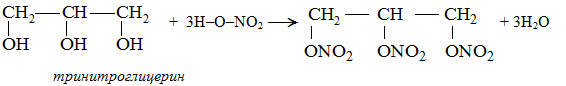
Или кислотные свойства:
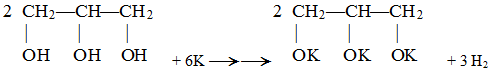
2. Особенные:
1. Соединения, у которых рядом расположено несколько гидроксильных групп, сладкие на вкус. Глицерин добавляют в ликеры и конфетные начинки в качестве загустителя.
2. Взаимодействие с гидроксидом меди – качественная реакция на многоатомные спирты. Получается прозрачный раствор комплексного соединения интенсивного синего цвета: глицерата меди.