Краткий конспект подготовки к ЗНО по химии № 41 Обобщение сведений об органических соединениях
Качественные, т.е. нерасчетные задачи можно условно разделить на несколько типов.
I. Задачи на объяснение фактов или тенденций
Задача 1.
Условие задачи. Согласно справочным данным, фенол представляет собой бесцветные прозрачные кристаллы. Тем не менее химический реактив фенол, стоящий в банке на полке, всегда окрашен в розовый цвет. Почему?

Решение.
Вспомним особенности строения фенола.
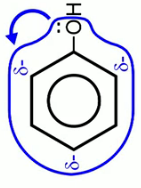
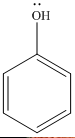
Поскольку – это бензольное кольцо, к которому присоединен атом заместителя кислорода, содержащего неподеленную электронную пару, то происходит взаимодействие электронов кислорода и бензольного кольца.
В результате происходит соряжение π-электронов бензольного кольца и электронной пары атома кислорода. Активность всего бензольного кольца сущетвенно возрастает. Получается вещество гораздо менне устойчиво к окислению по сранению с исходным бензолом.
Поэтому фенол всегда загрязнен продуктами окисления, имеющими яркую окраску. В результате, он имеет характерный розовый цвет.
II. Задачи на сравнение свойств веществ
Задача 1.
Условие задачи. Как изменятся свойства уксусной кислоты, при замене водородов в метильном радикале на атомы хлора:  →
→  →
→  →
→  ?
?
Решение.
При замещении водорода хлором, хлор как более электроотрицательный атом стягивает на себя электронную плотность.
Эта электронная плотность смещается от карбоксильной группы и соответственно от карбоксильного атома водорода  <
<  <
<  <
<
Атом водорода приобретает более положительный заряд. Уксусная кислота с заменой водорода на хлор в своем углеводородном радикале становится более легко диссоциирующей.
У нее становится более высокая константа диссоциации по сравнению с исходной уксусной кислотой. <
<  <СНCl2-СООН< СCl3-СООН
<СНCl2-СООН< СCl3-СООН
Трихлоруксусная кислота  уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
III. Задачи на качественный анализ органических соединений
Задача 1.
Условие задачи. Соединение А – легкокипящая жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода. Плотность паров одного из этих соединений В – лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди (II) в вещество С, которое используется для сохранения биологических препаратов.
Приведите возможные формулы веществ А, В, С.
Решение.
То, что могло быть окислено оксидом меди (II), является альдегидом. →
→ 
Делаем предположение: вещество С – альдегид. При этом данный альдегид используется для хранения биологических препаратов. Биологические препараты хранят в растворе формалина. Вещество – С – формальдегид (метаналь)  .
.
Формальдегид получился из метанола. Значит, вещество В – это метанол. →
→ 
Метанол  немного тяжелее воздуха.
немного тяжелее воздуха.  = 32 г/моль,
= 32 г/моль,  (воздуха) = 29 г/моль.
(воздуха) = 29 г/моль.
Поскольку при гидролизе исходного вещества получились два вещества с одинаковым числом атомов углерода  →
→  , то кислота с одним атомом углерода – это
, то кислота с одним атомом углерода – это  – муравьиная кислота.
– муравьиная кислота.
Исходное вещество А – с приятным запахом – это  – метиловый эфир муравьиной кислоты.
– метиловый эфир муравьиной кислоты.
Ответ: А -  ; В -
; В -  ; С – формальдегид
; С – формальдегид  .
.
IV. Задачи на различение веществ
Задача 1.
Условие задачи. В трех пробирках находятся три водных раствора: муравьиной кислоты НCOOH, соляной кислоты HCl и этанола C2H5-OH.Как, используя минимальное количество реактивов различить вещества в пробирках?
Решение.
1. Во все три пробирки добавляем индикатор, например, метилоранж. В растворах кислот, он изменит свой цвет на красный.
В оставшейся пробирке – этанол  .
.
2. Муравьиная кислота  является еще и альдегидом. Действуем на обе кислоты щелочным раствором
является еще и альдегидом. Действуем на обе кислоты щелочным раствором  .
. ↓
↓ →
→  ↓
↓  ↑
↑
 ↓ - осадок красного цвета.
↓ - осадок красного цвета.
3. В пробирке с соляной кислотой HCl синий осадок  ↓ просто растворится.
↓ просто растворится. ↓
↓ →
→  ↓
↓











