Краткий конспект подготовки к ЗНО по химии № 8 Оксиды
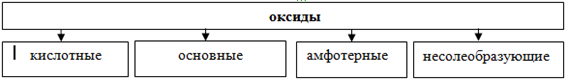
Классификация оксидов
По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды - это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную  , либо ионную кристаллическую решетку (твердые
, либо ионную кристаллическую решетку (твердые  или
или  ).
).
По кислотно-основным свойствам оксиды делятся на:
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
1. Основные оксиды.
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления.( ).
).
2. Кислотные оксиды.
Кислотные оксиды – это оксиды неметаллов ( ) и некоторых переходных металлов в высоких степенях окисления (
) и некоторых переходных металлов в высоких степенях окисления ( ).
).
3. Амфотерные оксиды.
К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
Это:  .
.
4. Несолеобразующие оксиды.
Несолеобразующие оксиды представлены в основном такими:  .
.
Физические свойства оксидов
Оксиды обладают физическими свойствами. Многие оксиды неметаллов при стандартных условиях газообразны  , оксиды азота. Есть жидкие оксиды. Это, например,
, оксиды азота. Есть жидкие оксиды. Это, например,  . Большинство оксидов металлов – твердые (
. Большинство оксидов металлов – твердые ( )
)
Оксиды бывают бесцветными ( ) или имеют окраску, например
) или имеют окраску, например  – бурый газ (лисий хвост).
– бурый газ (лисий хвост).

Химические свойства оксидов
1. Отношение к воде:
С водой реагируют оксиды щелочных и щелочноземельных металлов.( )
)


Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение  .
.


Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2. Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
Основные оксиды взаимодействуют с кислотами с образованием соли и воды.

Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.


Такая реакция может протекать, как в растворе, так и при сплавлении. При этом образуются различные продукты, в которой металл, образующий оксид находится в ионной форме.
Кислотные оксиды реагируют с основаниями, с образованием соли и воды.

Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.


Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.


2. При горении сложных веществ.


3. Термическое разложение некоторых сложных веществ.




Оксиды в природе
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов. Кварц и огромное количество его разновидностей. Массовая доля кварца и его разновидностей в земной коре составляет 60%.
Оксиды в природе.
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Диоксид циркония - чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии. Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии№10 "Оксиды"