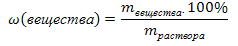Краткий конспект подготовки к ЗНО по химии № 7 Раствор
Качественный и количественный состав растворов
Раствор – это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности.
Жидкие растворы (в дальнейшем будем называть их просто «растворами») состоят из жидкого растворителя (чаще всего воды) и растворенного вещества, которое до смешения с растворителем могло быть твердым (например,  ), жидким (например,
), жидким (например,  ) или газообразным (например,
) или газообразным (например,  ).
).
Состав растворов обычно передаётся содержанием в них растворённого вещества в виде массовой доли или молярной концентрации.
Массовая доля и молярная концентрация растворённого вещества
Массовая доля ω (В) растворенного вещества В – это отношение его массы m (B) к массе раствора m (р), где m (р) = m (вещества) + m  .
.
Единица массовой доли вещества в растворе – доля от единицы или от 100%.
Пример:
Если в 100 г раствора находится 1 г  , то ω (
, то ω ( ) = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr).
) = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr).
Для приготовления 100 г 1%-ного раствора некоторой соли надо взять 1 г этой соли и 99 г воды.
Молярная концентрация – количество растворённого вещества (число молей) в единице объёма раствора.
Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации 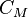
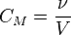
где:
ν – количество растворённого вещества, моль;
V – общий объём раствора, л.
Пример: Если в 1 л раствора содержится 1 моль KBr, то с (KBr) = 1 моль/л. Такой раствор называют одномолярным и обозначают 1М. Аналогичным образом записи 0,1М; 0,01М и 0,001М означают деци-, санти- и миллимолярный раствор.
Для приготовления 1 л 1М раствора KBr необходимо взять навеску соли с количеством вещества 1 моль (то есть 119 г), растворить ее в воде объемом, например, 0,8 л (то есть обязательно меньше 1 л) и затем довести объем раствора до 1 л добавлением воды.
Объем раствора V (р) при данной температуре связан с массой раствора m (р) и его плотностью (ρ) следующим образом: m (р) = ρ • V (р).
Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л).
Энергетика растворения
Процесс растворения твердого вещества в воде сопровождается разрушением кристаллической решетки (затрата энергии в форме теплоты, -Qкр) и гидратацией – образованием гидратов B  , то есть соединений переменного состава между частицами растворенного вещества и молекулами воды (выделение теплоты, +Qгидр).Рис.1.
, то есть соединений переменного состава между частицами растворенного вещества и молекулами воды (выделение теплоты, +Qгидр).Рис.1.
В результате общий тепловой эффект растворения равен
Q(р) = -Qкр + Qгидр
Если тепловой эффект растворения:
1. положительный (Q(р) больше 0), то после растворения вещества раствор становится теплее (например, это происходит в случае приготовления раствора  )
)
2. если же тепловой эффект отрицательный (Q(р) меньше 0), то раствор становится холоднее (иногда температура может опуститься ниже 0°С, например для  или
или  ).
).
3. В тех редких случаях, когда Q(р) = 0, температура раствора остается постоянной (например, для NaCl).
Переход в раствор жидких и газообразных веществ также сопровождается гидратацией их молекул и положительным тепловым эффектом.
Поэтому в соответствии с принципом Ле-Шателье повышение температуры ведет к уменьшению растворимости газов в воде.
Таким образом, растворение – это физико-химический процесс разрушения связей в исходных веществах и образования новых связей в гидратах. Это положение является основным содержанием химической теории растворов Д.И. Менделеева.
Кристаллогидраты
Многие гидраты оказываются настолько устойчивыми, что не разрушаются и приполном выпаривании раствора.
Так, известны твердые кристалогидраты:
 – пентагидрат сульфата меди(II)
– пентагидрат сульфата меди(II)
 – декагидрат карбоната натрия
– декагидрат карбоната натрия
 – додекагидрат сульфата алюминия-калия.
– додекагидрат сульфата алюминия-калия.
Если для приготовления раствора используют не безводное вещество, а его кристаллогидрат B  , то следует при расчетах учитывать воду, которая входит в состав кристаллогидрата (кр). Массу кристаллогидрата mкр определяют по формуле
, то следует при расчетах учитывать воду, которая входит в состав кристаллогидрата (кр). Массу кристаллогидрата mкр определяют по формуле
mкр =(mB/MB)Mкр,
где MB и Mкр– молярные массы соответственно безводного растворяемого вещества и его кристаллогидрата.
Определение массы воды  , которую следует добавить к рассчитанной массе кристаллогидрата для приготовления его раствора заданного состава, ведут по формуле
, которую следует добавить к рассчитанной массе кристаллогидрата для приготовления его раствора заданного состава, ведут по формуле
 = m(раствора) – mкр.
= m(раствора) – mкр.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №7 "Растворы"
Online-тест подготовки к ЗНО по химии№8 "Повторение"
Online-тест подготовки к ЗНО по химии №9 "Срез 1"