Краткий конспект подготовки к ЗНО по химии №5 Строение атома
Подготовка к ВНО. Химия.
Конспект 5. Строение атома
История открытия строения атома
В конце XIX – начале XX века физики доказали, что атом является сложной частицей и состоит из более простых (элементарных) частиц. Были обнаружены:
1. Катодные лучи (английский физик Дж. Дж. Томсон, 1897 г.),
2. Частицы, которые получили название электроны e − (несут единичный отрицательный заряд);
3. Естественная радиоактивность элементов (французские ученые – радиохимики А. Беккерель и М. Склодовская-Кюри, физик Пьер Кюри, 1896 г.) и существование α-частиц (ядер гелия  );
);
4. Наличие в центре атома положительно заряженного ядра (английский физик и радиохимик Э. Резерфорд, 1911 г.);
5. Искусственное превращение одного элемента в другой, например азота в кислород (Э. Резерфорд, 1919 г.). Из ядра атома одного элемента (азота – в опыте Резерфорда) при соударении с α-частицей образовывалось ядро атома другого элемента (кислорода) и новая частица, несущая единичный положительный заряд и названная протоном ( , ядро
, ядро  )
)
6. Наличие в ядре атома электронейтральных частиц – нейтронов  (английский физик Дж. Чедвик, 1932 г.).
(английский физик Дж. Чедвик, 1932 г.).
В результате проведенных исследований было установлено, что в атоме каждого элемента (кроме H) присутствуют протоны, нейтроны и электроны.
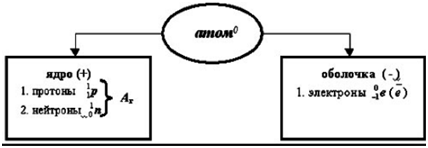
Строение атома.
Причем протоны и нейтроны сосредоточены в ядре атома, а электроны – на его периферии (в электронной оболочке).
Число протонов в ядре равно числу электронов в оболочке атома и отвечает порядковому номеру этого элемента в Периодической системе.
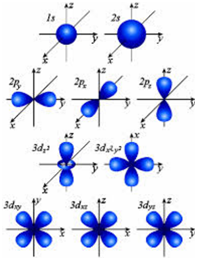
Электронная оболочка атома
Электронная оболочка атома представляет собой сложную систему. Она делится на под оболочки с разной энергией (энергетические уровни); уровни, в свою очередь, подразделяются на подуровни, а подуровни включают атомные орбитали, которые могут различаться формой и размерами (обозначаются буквами s, p, d, f и др.).
Форма s-орбитали – сферическая. Форма p-орбиталей (их число на p-подуровне равно 3) – гантелеобразная. Форма d-орбиталей (число которых на соответствующем d-подуровне равно 5) – более сложная. Еще сложнее форма f-орбиталей, число которых на f-подуровне равно 7.
Формы атомных орбиталей.
Максимальное число электронов на энергетическом уровне определяется по формуле N= 2n². Где n- номер энергетического уровня.
|
Энергетический уровень |
N |
|
1-ый |
2 |
|
2-ой |
8 |
|
3-ий |
18 |
|
4-ый |
32 |
Порядок заполнения электронного уровня атомов малых периодов
Чтобы составить схемы строения электронных оболочек атомов следует руководствоваться следующим алгоритмом:
А. определить общее число электронов на оболочке по порядковому номеру;
Б. определить число энергетических уровней по номеру периода;
В. определить число электронов на каждом энергетическом уровне, (пользуясь формулой 2n²)
Г. на внешней электронной оболочке у элементов главной подгруппы количество электронов соответствует номеру группы;
Д. у элементов побочной подгруппы на внешнем электронном слое 2 электрона, заполняется предпоследний электронный слой.
Атом водорода имеет порядковый номер 1, следовательно, имеет один электрон. Атом находится в 1 периоде, следовательно, в атоме один энергетический уровень. Схема распределения электронов по энергетическим уровням: )
) 
Записываем заряд атомного ядра, затем ставим скобку, символизирующую электронный уровень, рядом со скобкой внизу справа пишем число электронов, находящихся на данном уровне.
Распределение электронов по энергетическим уровням можно записать иначе:
Атом гелия имеет порядковый номер 2, следовательно, имеет 2 электрона. Атом находится в 1 периоде, следовательно, в атоме один энергетический уровень. Схема распределения электронов по энергетическим уровням:
He+2 )2 или 
Атом лития имеет порядковый номер 3, следовательно, имеет 3 электрона. Три электрона не могут поместиться на первом энергетическом уровне, т.к. его максимальная емкость равна 2е- (огласно формуле 2n²). Следовательно, третий электрон сформирует второй энергетический слой. Этот слой будет иметь больший радиус, чем первый. Это действительно отвечает положению лития в периодической системе химических элементов. Атом находится во 2 периоде, следовательно, в атоме два энергетических уровня. Схема распределения электронов по энергетическим уровням:
Li+3 )2 )1 или 
Рассуждая, таким образом, рассмотрим схему заполнения энергетических уровней у некоторых элементов малых периодов:
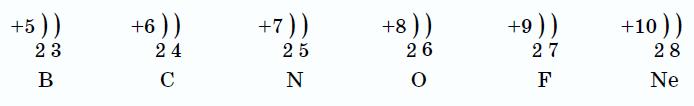
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Порядок заполнения электронного уровня атомов больших периодов
В состав второго и третьего периодов входит по 8 элементов. В состав четвёртого периода входит на 10 элементов больше, т.е. четвёртый период включает в себя 18 элементов. Куда же помещаются электроны у элементов, следующих за кальцием? Вспомним, что элементы групп Б – металлы, которым характерна валентность II. Единственное, что можно предложить – продолжить заполнение предпоследнего электронного слоя. Так, для скандия можно представить следующую модель строения атома:
Sc +21 ) ) ) )
2 8 9 2
Десять «лишних» элементов 4-го периода завершаются атомом цинка. На внешнем электронном слое этого элемента находится два электрона, а на предпоследнем – 18.
Zn +30 ) ) ) )
2 8 18 2
За счёт того, что на предпоследнем электронном слое у элементов четвёртого периода можно расположить ещё 10 электронов, в четвёртом периоде на 10 химических элементов больше, чем в третьем.
Выводы:
1. Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
2. У элементов групп А номер группы, к которой относится элемент, равен числу внешних электронов атома.
3. Периодическая повторяемость свойств элементов связана с тем, что в атомах при переходе от периода к периоду начинает заполняться новый электронный слой, то есть периодически повторяется число внешних электронов на внешнем электронном слое.
4. Существование больших периодов объясняется заполнением электронами предпоследних (внутренних) электронных слоёв.
Графическая схема строения электронных слоев атомов (электронно-графическая формула)
Для описания расположения электронов на атомных орбиталях, используют электронную конфигурацию.
Для её написания в строчку пишутся орбитали в условных обозначениях (s, p-, d-,f- орбитали), а перед ними числа, обозначающие номер энергетического уровня. Чем больше число, тем дальше электрон находится от ядра. В верхнем регистре, над обозначением орбитали, пишется количество электроном, находящихся на данной орбитали.
Электронная конфигурация атома скандия .
.
Электроны внешнего энергетического уровня называются валентными. относится к d-элементам.
относится к d-элементам.
Графически распределение электронов на атомных орбиталях,можно представить в виде ячеек.
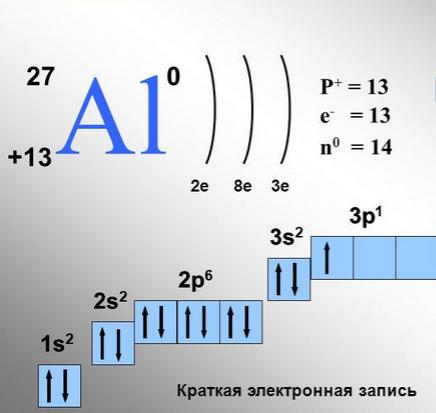
Распределение электронов в атоме алюминия.
Каждая ячейка соответствует одной орбитали. Для р-орбитали таких ячеек будет три, для d-орбитали – пять, для f-орбитали- семь. В одной ячейке может находиться 1 или 2 электрона.
Существует правило (оно называется правилом Гунда), по которому электроны предпочитают расселяться на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами.
Когда орбиталь заселяется двумя электронами, такие электроны называют спаренными. Электроны заселят их так, что на каждой из этих p-орбиталей окажется по одному электрону. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №5 "Строение атома"











