Краткий конспект подготовки к ЗНО по химии №4 Периодический закон и периодическая система химических элементов Д. И. Менделеева
Подготовка к ВНО. Химия.
Конспект 4. Периодический закон и периодическая система химических элементов Д. И. Менделеева
Открытие Периодического закона
Основной закон химии – Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым, и о его внутреннем строении ничего не было известно. В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее – атомные веса) и химические свойства элементов. Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д. И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств. Например, свойства типичного металла лития  повторялись у элементов натрия
повторялись у элементов натрия  и калия
и калия  , свойства типичного неметалла фтора
, свойства типичного неметалла фтора  – у элементов хлора
– у элементов хлора  , брома
, брома  , иода
, иода  .
.
У некоторых элементов Д. И. Менделеев не обнаружил химических аналогов (например, у алюминия  и кремния
и кремния  ), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия – галлия
), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия – галлия  , аналога кремния – германия
, аналога кремния – германия  и др.) предсказания Д. И. Менделеева полностью подтвердились.
и др.) предсказания Д. И. Менделеева полностью подтвердились.
Периодический закон в формулировке Д.И. Менделеева
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Периодическая система химических элементов
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов. Она состоит из 7 периодов и 8 групп (короткопериодный вариант таблицы).
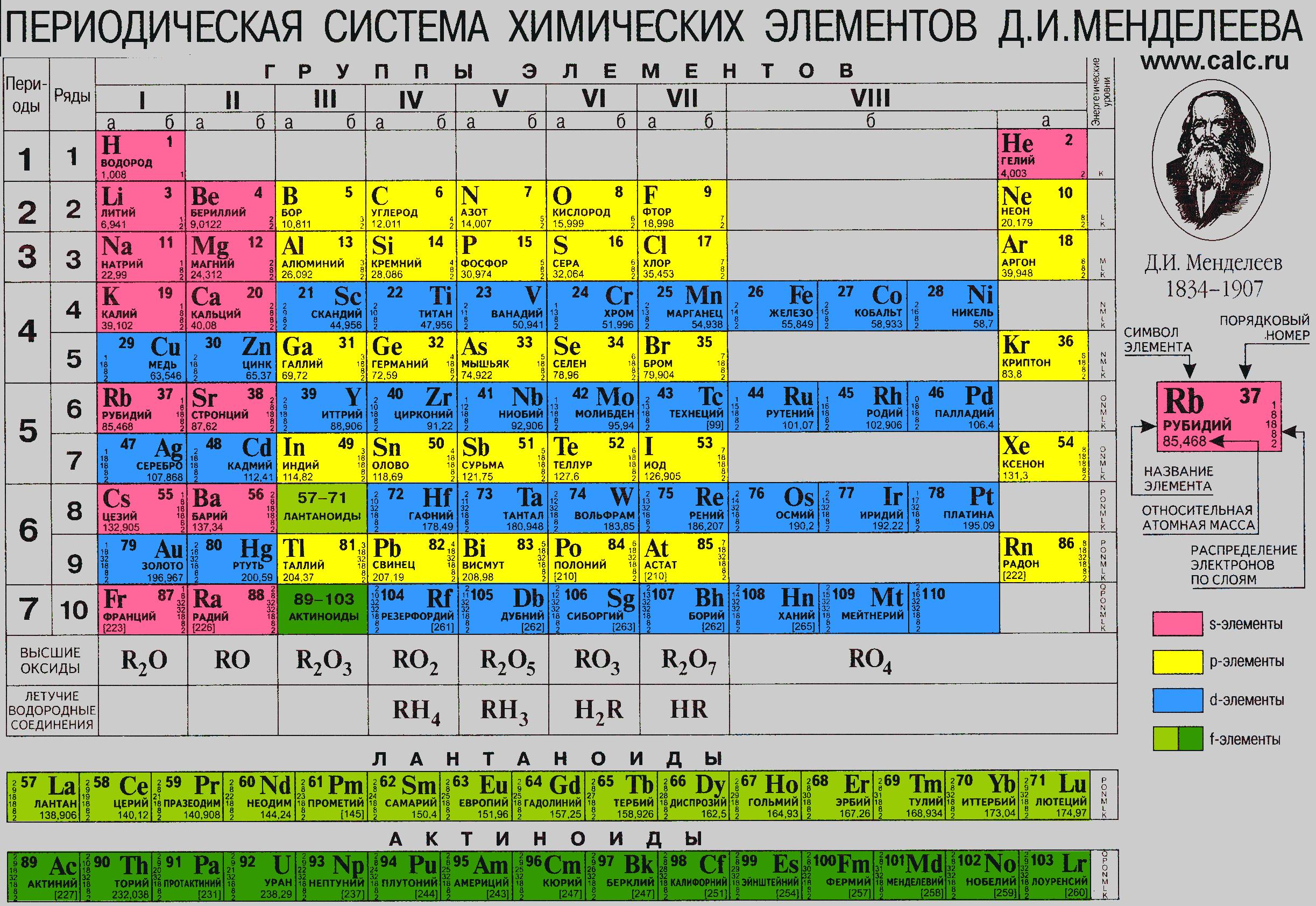
Периоды – это горизонтальные ряды таблицы. Они подразделяются на малые и большие.
В малых периодах находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды), В больших периодах – 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Каждый период начинается с типичного металла, а заканчивается благородным газом.
Группы – это вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Короткопериодный вариант Периодической системы включает подгруппы элементов (главную и побочную).
Подгруппа – это совокупность элементов, являющихся безусловными химическими аналогами; часто элементы подгруппы обладают высшей степенью окисления, отвечающей номеру группы.
В А-группах химические свойства элементов могут меняться в широком диапазоне от неметаллических к металлическим (например, в главной подгруппе V группы азот – неметалл, а висмут – металл).
В Периодической системе типичные металлы расположены в IА группе ( ),
),
IIА ( ) и IIIА (
) и IIIА ( ).
).
Неметаллы расположены в группах VIIА ( ), VIА (
), VIА ( ), VА (
), VА ( ), IVА (
), IVА ( ) и IIIА (
) и IIIА ( ).
).
Некоторые элементы А-групп (бериллий  , алюминий
, алюминий  , германий
, германий  , сурьма
, сурьма  , полоний
, полоний  и другие), а также многие элементы Б-групп проявляют и металлические, и неметаллические свойства (явление амфотерности).
и другие), а также многие элементы Б-групп проявляют и металлические, и неметаллические свойства (явление амфотерности).
Некоторые главные подруппы имеют свои особенные названия:
| I-a | Щелочные металлы |
| II-a | Щелочноземельные металлы |
| V-a | Пниктогены |
| VI-a | Халькогены |
| VII-a | Галогены |
| VIII-a | Благородные (инертные) газы |
В каждой ячейке, соответствующей элементу, представлены: химический символ, название, порядковый номер, соответствующий числу протонов в атоме, относительная атомная масса.
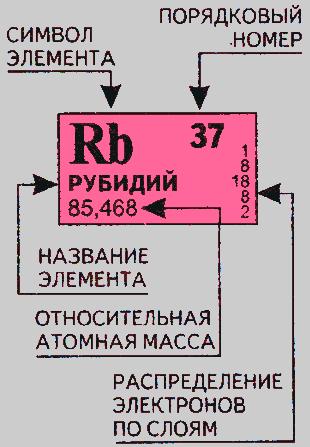
Число электронов в атоме соответствует числу протонов. Количество нейтронов в атоме можно найти, по разности меду относительной атомной массой и количеством протонов, т.е. порядкового номера. 
У каждой группы есть формула высшего оксида, т.е. оксиды с максимальной степенью окисления элементов. Эта информация написана внизу таблицы.
Например, для элементов V группы, формула высшего оксида:  . Это
. Это  .
.
По составу высшего оксида элемента можно определить его свойства. Оксиды состава  – основные,
– основные,  – чаще всего – амфотерные. Остальные оксиды – кислотные. Чем выше степень окисления элемента
– чаще всего – амфотерные. Остальные оксиды – кислотные. Чем выше степень окисления элемента  , чем ярче выраженными кислотными свойствами обладает его оксид.
, чем ярче выраженными кислотными свойствами обладает его оксид.
Таким образом, кислотность высших оксидов элементов главных подгрупп увеличивается по периоду слева направо.
В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы IV-VII групп, причем только легких.
Изменение атомного радиуса
В группах: Для элементов главных подгрупп, сверху вниз увеличивается число энергетических уровней. Энергетический уровень – это и есть расстояние, на котором находится электрон от ядра. Значит, по группе вниз атомный радиус увеличивается.
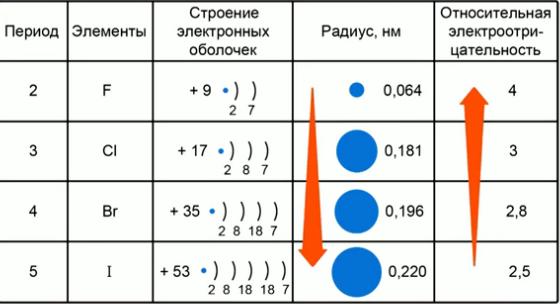
В периодах: По периоду номер энергетического уровня, на котором находятся валентные электроны, остается неизменным, но число валентных электронов увеличивается, а также растет и заряд ядра.
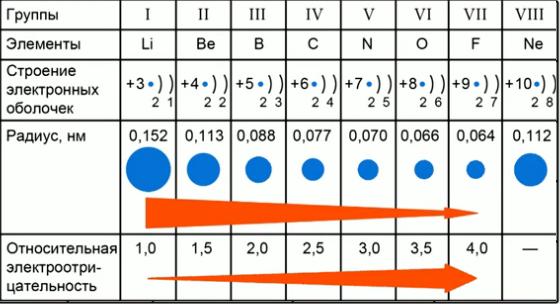
Значит, электроны электростатически сильнее притягиваются к ядру. Поэтому радиус атома уменьшается.
Закономерности изменения периодических свойств
| Параметр | По группе вниз | По периоду вправо |
| Заряд ядра | Увеличивается | Увеличивается |
| Число валентных электронов | Не меняется | Увеличивается |
| Число энергетических уровней | Увеличивается | Не меняется |
| Радиус атома | Увеличивается | Уменьшается |
| Электроотрицательность | Уменьшается | Увеличивается |
| Металлические свойства | Увеличиваются | Уменьшаются |
| Степень окисления в высшем оксиде | Не меняется | Увеличивается |
|
Степень окисления в водородных соединениях (для элементов IV-VII групп) |
Не меняется | Увеличивается |
Современная формулировка закона: свойства химических элементов, простых веществ, также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №4 "Периодический закон"











