Краткий конспект подготовки к ЗНО по химии № 2 Вещество
Подготовка к ВНО. Химия.
Конспект 2. Вещество
Классификация неорганических веществ
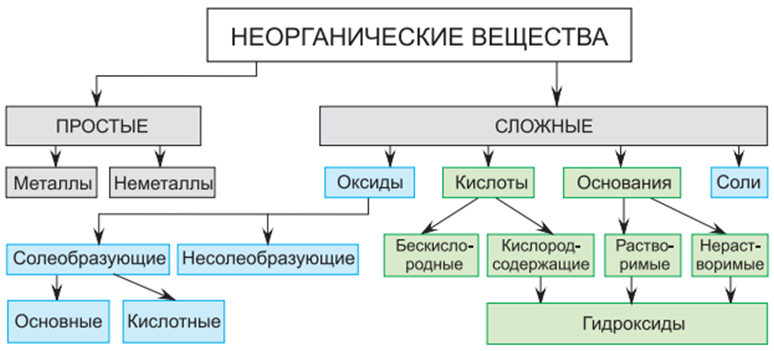
Простые вещества делятся на металлы и неметаллы. Такое деление основано, прежде всего, на их физических и химических свойствах.
Металлы обладают ярко выраженными физическими свойствами. Они непрозрачны, имеют характерный блеск, электропроводны, теплопроводны. Металлы пластичны, т.е. не дробятся как хрупкие вещества, например, стекло, а расплющиваются.
Неметаллы отличаются разнообразием физических свойств.
Среди них есть газообразные вещества ( , инертные газы
, инертные газы  ), твердые легкоплавкие (
), твердые легкоплавкие ( ) и тугоплавкие (алмаз, графит, кремний) вещества, и жидкости (бром).
) и тугоплавкие (алмаз, графит, кремний) вещества, и жидкости (бром).
Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Явление аллотропии обусловлено в одних случаях тем, что молекулы простого вещества состоят из различного числа атомов ( ), в других – тем, что их кристаллы имеют различное строение (алмаз, графит, карбин).
), в других – тем, что их кристаллы имеют различное строение (алмаз, графит, карбин).
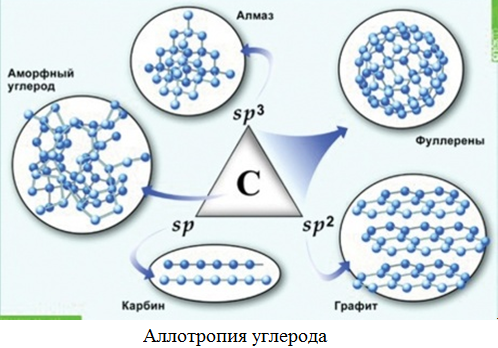
Аллотропные модификации характерны для кислорода, серы, углерода, фосфора, кремния, олова, мышьяка и других химических элементов.
Классификация сложных веществ
В химии важно построить такую классификацию, веществ, которая бы помогла сориентироваться в их химических свойствах.
Сложные вещества подразделяются на четыре класса химических соединений:
1. оксиды,
2. основания,
3. кислоты,
4. соли.
Оксиды. В составе любого оксида всегда два элемента, один из которых кислород.
Внутри класса выделяют группы, называемые основными ( и др.) и кислотными (
и др.) и кислотными ( и др.) и несолеобразующими (
и др.) и несолеобразующими ( ) оксидами.
) оксидами.
Основания. Каждому основному оксиду соответствует основание – вещество, состоящее из металла и гидроксогруппы. Основания в зависимости от растворимости в воде подразделяют на щёлочи ( ) и нерастворимые в воде основания (
) и нерастворимые в воде основания ( ). Такое подразделение важно, так как, несмотря на сходство состава, у щелочей и нерастворимых оснований много различий в свойствах.
). Такое подразделение важно, так как, несмотря на сходство состава, у щелочей и нерастворимых оснований много различий в свойствах.
Кислоты. Каждому кислотному оксиду соответствует кислородосодержащая кислота, в состав которой входит водород и кислотный остаток. ( ) Среди кислот встречаются и бескислородные кислоты (
) Среди кислот встречаются и бескислородные кислоты ( ).
).
Соли. При взаимодействии веществ, имеющих противоположные свойства, например кислотного и основного оксида, кислоты и основания, получаются соли – вещества, состоящие из металла и кислотного остатка ( ).
).
Есть неорганические вещества, которые не относятся ни к одному из упомянутых классов, например, гидриды металлов, нитриды, карбиды:  .
.
Количественные расчёты в химии
Количественные расчеты в химии ведут по формулам веществ (чтобы найти количественный состав сложного вещества, массовые доли элементов в нём) и уравнениям реакций (чтобы определить мольные, массовые и объёмные отношения между реагентами и продуктами). Такие расчеты называют стехиометрическими.

Относительная молекулярная масса. Количество вещества.
Число Авогадро
Относительная молекулярная масса  – отношение массы молекулы к атомной единице массы (
– отношение массы молекулы к атомной единице массы ( г). Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества.
г). Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества.
Количество вещества n – это физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого вещества.

Молярная масса
Количество вещества 1 моль, то есть порция, обязательно содержащая  частиц, обладает определенной массой, характерной для данного вещества – молярной массой (обозначение М).
частиц, обладает определенной массой, характерной для данного вещества – молярной массой (обозначение М).
Молярную массу вещества  можно определить как отношение массы данной порции вещества
можно определить как отношение массы данной порции вещества  к количеству вещества
к количеству вещества  в этой порции:
в этой порции:

Единица измерения молярной массы: г/моль.
Массовая доля элемента в сложном веществе
По известной химической формуле сложного вещества определяют массовые доли элементов, входящих в это вещество.
Массовая доля элемента  в общей массе сложного вещества – это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого):
в общей массе сложного вещества – это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого):

Массовая доля элемента – это доля от единицы или от 100%. В сложном веществе  всегда меньше единицы (или меньше 100%).
всегда меньше единицы (или меньше 100%).
Например, для воды 
 (11%) и
(11%) и  (89%). Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%).
(89%). Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%).
Закон Авогадро. Молярный объем газа. Относительная плотность газа

Первое следствие из закона Авогадро:
При одинаковых условиях равные количества различных газов занимают равные объёмы.
В частности, при нормальных условиях (н. у.) – температуре  (
( ) и давлении
) и давлении  Па (1 атм, 760 мм. рт. ст.) – 1 моль любого газа (близкого по свойствам к идеальному газу), занимает объём 22,4 л.
Па (1 атм, 760 мм. рт. ст.) – 1 моль любого газа (близкого по свойствам к идеальному газу), занимает объём 22,4 л.
Эта физическая постоянная – молярный объём газа при нормальных условиях.
Молярный объём газа  равен отношению объёма порции газа В:
равен отношению объёма порции газа В:  к количеству вещества в этой порции
к количеству вещества в этой порции  :
:

Единица измерения молярного объёма газа: л/моль. При нормальных условиях  = 22,4 л/моль.
= 22,4 л/моль.
Из определения для  следует, что
следует, что

Это выражение позволяет рассчитывать по массе газа его объем.
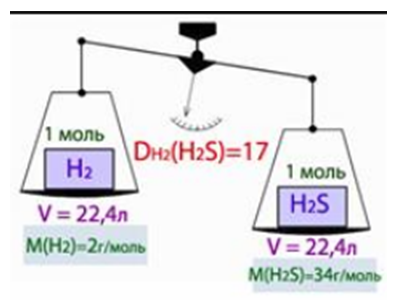
Второе следствие из закона Авогадро:
Молярная масса вещества в газообразном состоянии равна его удвоенной относительной плотности по водороду:
 .
.
Аналогичным образом, с учетом средней молярной массы воздуха  г/моль:
г/моль:
Относительная плотность по водороду  , по воздуху
, по воздуху  и по любому другому газу определяется экспериментально, что позволяет рассчитать молекулярную массу газа.
и по любому другому газу определяется экспериментально, что позволяет рассчитать молекулярную массу газа.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №3 "Законы в химии. Химическая реакция"











