Краткий конспект подготовки к ЗНО по химии №33 Карбоновые кислоты
Конспект 33. Карбоновые кислоты
Карбоновые кислоты часто называют просто органическими кислотами за их кислотные свойства. Свойства карбоновых кислот обусловлены наличием в них карбоксильной группы или карбоксила. Карбоксильная группа образована сочетанием двух групп:
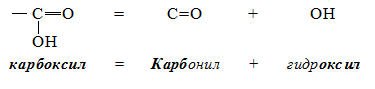
Карбоксильная группа – СООН – функциональная группа карбоновых кислот.
Номенклатура карбоновых кислот
Название кислот образуется так, что к названию предельного углеводорода прибавляется
-овая кислота.
Тривиальные названия важнейших кислот
Алифатические предельные одноосновные кислоты:
НСООН муравьиная уксусная
уксусная пропионовая
пропионовая
Непредельные кислоты: акриловая
акриловая олеиновая
олеиновая
Ароматические кислоты: бензойная
бензойная
Двухосновные кислоты: щавелевая
щавелевая малоновая
малоновая
Физические свойства карбоновых кислот
Водородные связи (прочнее, чем у молекул спиртов!)
1. температуры кипения и плавления карбоновых кислот намного выше, не только чем у соответствующих углеводородов, но и чем у спиртов;
2. хорошая растворимость в воде (с увеличением углеводородного радикала уменьшается).
Водородные связи в карбоновых кислотах настолько сильны, что эти вещества образуют димеры:
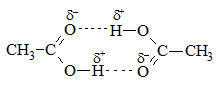
Химические свойства карбоновых кислот
1. Наличие свободного иона водорода в растворах кислот обуславливает их кислый вкус и взаимодействие с индикаторами.
2. Кислоты взаимодействуют с активными металлами, выделяя водород:
 →(СН3СOO)2Mg +
→(СН3СOO)2Mg +  .
.
этанат магния
(ацетат магния)
3. Реакции c основаниями: →
→ .
.
4. Реакции с основными оксидами: →
→ .
.
5. Реакции с солями более слабых кислот: →
→ ↓.
↓.
Муравьиная кислота
Это вещество можно рассматривать не только как кислоту, но и как альдегид. Коричневым цветом обведена альдегидная группа.
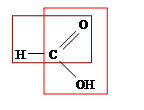
Поэтому муравьиная кислота проявляет типичные для альдегидов восстановительные свойства:
1. Реакция серебряного зеркала:
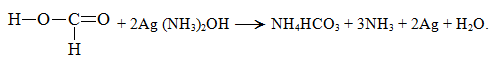
2. Реакция с гидроксидом меди при нагревании: ↓ +
↓ +  .
.
3. Окисление хлором до углекислого газа:
Концентрированная серная кислота отбирает у муравьиной кислоты воду. При этом образуется монооксид углерода: ↑.
↑.
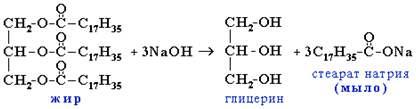
Строение и свойства мыла
В промышленности проводят щелочной гидролиз жиров, при этом образуется глицерин и смесь солей жирных кислот – мыло:
Действие мыла.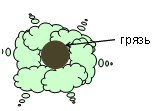 Почему растворы мыла растворяют частички грязи?
Почему растворы мыла растворяют частички грязи?
Потому что анион соли жирной кислоты состоит из двух частей: гидрофильной (полярный остаток карбоксильной группы, на котором сосредоточен отрицательный заряд) и гидрофобной (большой углеводородный радикал).
Гидрофильность – сродство к воде, способность к электростатическому взаимодействию с молекулами воды.
Гидрофобность – отсутствие сродства к воде, неспособность к электростатическому взаимодействию с молекулами воды, приводящие к выталкиванию из водной среды.
Углеводородные радикалы мыла прилипают к грязевой частице, а гидрофильная часть взаимодействует с водой. В результате грязь отрывается от поверхности и переходит в раствор, где другие анионы мыла окружают ее со всех сторон и не дают осесть обратно:











