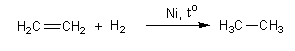Краткий конспект подготовки к ЗНО по химии №26 Алкены
Алкены (олефины, этиленовые углеводороды) – углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – .
.
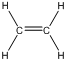
Первый член ряда – этилен (этен)  :
:
Номенклатура алкенов
Двойную связь обозначают с помощью суффикса -ен. Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь. - гексен-2 (гексен-4)
- гексен-2 (гексен-4)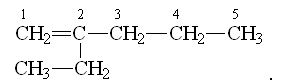
2-этилпентен-1
Строение алкенов
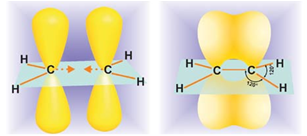
Атомы углерода при двойной связи находятся в состоянии  -гибридизации. Двойная связь состоит из
-гибридизации. Двойная связь состоит из  -связи, образованной
-связи, образованной  -гибридными орбиталями, и
-гибридными орбиталями, и  -связи, возникающей за счет перекрывания p-орбиталей. Три
-связи, возникающей за счет перекрывания p-орбиталей. Три  -связи атома углерода направлены к вершинам треугольника с атомом
-связи атома углерода направлены к вершинам треугольника с атомом  в центре, угол между связями
в центре, угол между связями 
 .
.
Молекула этилена плоская, а электронная плотность  -связи расположена над и под этой плоскостью. В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи. В углеродных соединениях
-связи расположена над и под этой плоскостью. В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи. В углеродных соединениях  – связь значительно слабее, чем
– связь значительно слабее, чем  – связь. Под воздействием реагентов
– связь. Под воздействием реагентов  – связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
– связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
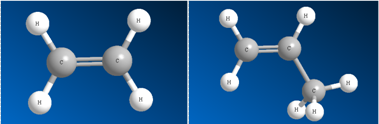
Этен Пропен
Изомерия алкенов
1. Изомерия углеродного скелета.
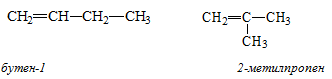
2. Изомерия положения двойной связи.
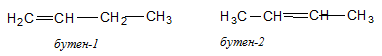
3. Межклассовая изомерия (с циклоалканами)
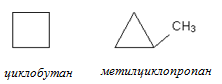
4. Геометрическая изомерия.
Вращения вокруг двойной связи не происходит, ведь для этого нужно разорвать  -связь. Из-за этого у алкенов существует изомерия, связанная с тем, что заместители могут располагаться по одну или по разные стороны двойной связи, как, например, у бутена-2.
-связь. Из-за этого у алкенов существует изомерия, связанная с тем, что заместители могут располагаться по одну или по разные стороны двойной связи, как, например, у бутена-2.
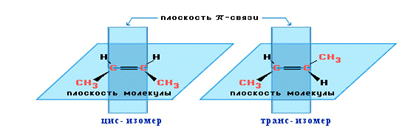
Для бутена-1 геометрическая изомерия невозможна (у одного из атомов С при двойной связи оба заместителя одинаковы: 2 атома водорода).
Физические свойства алкенов
Этен, пропен и бутен – газы. Алкены, содержащие от 5 до 18 атомов  в молекуле – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества.
в молекуле – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества.
Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом.
Химические свойства алкенов
1. Галогенирование.
Непредельные соединения быстро обесцвечивают раствор брома в воде – бромную воду. Это – качественная реакция на кратные связи.
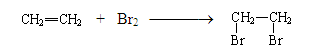
2. Гидрогалогенирование.
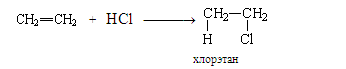
3. Присоединение серной кислоты.
Серная кислота обязательно должна быть концентрированной.
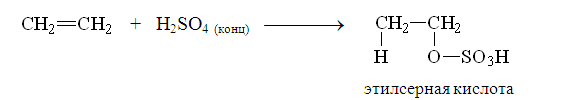
4. Гидратация.
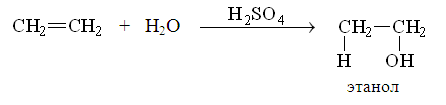
5. Гидрирование.