Краткий конспект подготовки к ЗНО по химии №23 Подгруппа карбона
В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р – элементы IV-A группы периодической системы Д.И.Менделеева.
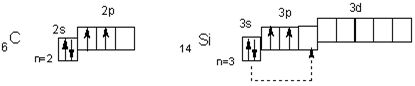
Электронное строение атомов
Атомы элементов подгруппы углерода на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств. Электронное строение внешних уровней атомов первых двух элементов подгруппы можно представить так
В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние распаривают электроны s-подуровней (показано пунктирными стрелками).
Свойства элементов подгруппы углерода
В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2. Степень окисления -4 в последовательности C – Pb становится все менее характерной.
|
Свойства |
С |
Si |
Ge |
Sn |
Pb |
|
Порядковый номер |
6 |
14 |
32 |
50 |
82 |
|
Валентные электроны |
|
|
|
|
|
|
Относительная |
2,50 |
1,74 |
2,02 |
1,72 |
1,55 |
|
Степень окисления в соединениях |
+4, +2, -4 |
+4, +2, -4 |
+4, -4 |
+4, +2, -4 |
+4, +2, -4 |
Элементы подгруппы углерода образуют оксиды общей формулы  и RO, а водородные соединения – формулы
и RO, а водородные соединения – формулы  .
.
Химические свойства углерода и кремния
Графит и кремний – типичные восстановители.
Взаимодействие с кислородом.
При нагревании с избытком воздуха графит (именно этот аллотроп наиболее доступен) и кремний образуют диоксиды: ,
,  ,
,
при недостатке кислорода можно получить монооксиды CO или SiO: ,
, ,
,
которые образуются также при нагревании простых веществ с их диоксидами: ,
,  .
.
Взаимодействие с неметаллами.
Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды  и
и  , при нагревании – с хлором, давая
, при нагревании – с хлором, давая  и
и  . При более сильном нагревании углерод и кремний реагируют с серой и азотом:
. При более сильном нагревании углерод и кремний реагируют с серой и азотом: ,
, ,
,
и даже между собой, образуя карборунд – вещество, по твердости близкое к алмазу: .
.
Взаимодействие с кислотами и щелочами.
Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные  и
и  окисляют углерод:
окисляют углерод: ↑+ 2
↑+ 2 ↑ +
↑ +  ,
, ↑ +
↑ +  {/mathpublisher}↑ +
{/mathpublisher}↑ + .
.
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот: ↑ + 4NO↑ +
↑ + 4NO↑ + .
.
Кроме того, кремний растворяется в водных растворах щелочей: ↑.
↑.
Угольная кислота и карбонаты
Оксид углерода (IV) является ангидридом угольной кислоты  и обладает всеми свойствами кислотных оксидов.
и обладает всеми свойствами кислотных оксидов.
Как двухосновная кислота она образует средние соли – карбонаты и кислые – гидрокарбонаты. Качественная реакция на эти соли – действие на них сильных кислот, при котором кислота вытесняется и разлагается с выделением  :
: ↑,
↑, ↑.
↑.
При пропускании выделяющегося  в известковую воду выпадает белый нерастворимый осадок; этой реакцией пользуются также для обнаружения оксида углерода (IV):
в известковую воду выпадает белый нерастворимый осадок; этой реакцией пользуются также для обнаружения оксида углерода (IV): ↓ +
↓ +  .
.
Из всех карбонатов в воде растворимы карбонаты только щелочных металлов и аммония. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Под действием избытка оксида углерода (IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты:
|
|
+ |
|
+ |
|
= |
|
|
взвесь в воде |
избыток |
|||||
Гидрокарбонаты при нагревании распадаются на карбонаты, углекислый газ и воду: ↑.
↑.
Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода: ↑.
↑.
Из солей угольной кислоты наибольшее практическое значе¬ние имеет сода; известны различные кристаллогидраты соды  или
или  ; наиболее устойчивым кристаллогидратом является
; наиболее устойчивым кристаллогидратом является  , который обычно называют кристаллической содой. При прокаливании получают безводную, или кальцинированную соду
, который обычно называют кристаллической содой. При прокаливании получают безводную, или кальцинированную соду  . Широко используется также питьевая сода
. Широко используется также питьевая сода  .
.