Краткий конспект подготовки к ЗНО по химии №19 Водород и его соединения
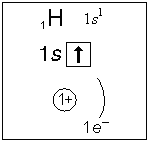
Электронное строение атома водорода
Ядро атома водорода имеет заряд (+1), то есть содержит только один протон, соответственно только один электрон на единственном энергетическом уровне. Схематично это представлено ниже, записывается с помощью электронной формулы следующим образом:
Физические свойства водорода 
Молекула  содержит неполярную σ-связь. Простое вещество водород
содержит неполярную σ-связь. Простое вещество водород  лёгкий бесцветный газ, без запаха и вкуса, устойчив к нагреванию до 2000 °С. Практически не растворяется в воде. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
лёгкий бесцветный газ, без запаха и вкуса, устойчив к нагреванию до 2000 °С. Практически не растворяется в воде. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
Физические константы: ,
, г/л (н.у.),
г/л (н.у.), пл
пл  ,
, кип
кип
Химические свойства
Водород  может проявлять в одних условиях восстановительные свойства (чаще), в других условиях – окислительные свойства (реже):
может проявлять в одних условиях восстановительные свойства (чаще), в других условиях – окислительные свойства (реже):
восстановитель 
окислитель 
При обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
и с единственным неметаллом – фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
Он может «отнимать» кислород от некоторых оксидов, например:
Записанное уравнение отражает восстановительные свойства водорода. →
→ 
С галогенами образует галогеноводороды: →
→  , реакция протекает со взрывом в темноте и при любой температуре,
, реакция протекает со взрывом в темноте и при любой температуре,
 →
→  , реакция протекает со взрывом, только на свету.
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании: →
→ 
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды: →
→ 
Качественная реакция на водород – сгорание с "хлопком" собранного в пробирку газа.
Распространённость
Водород – самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов. Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Три изотопа водорода имеют собственные названия: – протий (
– протий ( ),
),  – дейтерий (
– дейтерий ( ) и
) и  – тритий (радиоактивен) (
– тритий (радиоактивен) ( ).
).
Получение
Основной промышленный способ получения водорода – реакция с водой метана. ↑
↑ −165 кДж
−165 кДж
В лаборатории.
Действие разбавленных кислот на металлы.  →
→  ↑
↑
Применение
1. При производстве аммиака, метанола, мыла и пластмасс.
2. При производстве маргарина из жидких растительных масел.
3. Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ).











