Краткий конспект подготовки к ЗНО по химии №15 Щелочноземельные металлы
Физические свойства щелочноземельных металлов
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И.Менделеева. Это магний  , кальций
, кальций  , стронций
, стронций  , барий
, барий  и радий
и радий  .
.
Практически все эти элементы представляют собой твердые вещества сероватого цвета (по крайне мере, при нормальных условиях и комнатной температуре). Кстати, физические свойства щелочных металлов немного отличаются – эти вещества хотя и довольно стойкие, но легко поддаются воздействию. Интересно, что с порядковым номером в таблице растет и такой показатель металла, как плотность. Например, в этой группе наименьшим показателем обладает кальций, в то время как радий по плотности сходен с железом.
Химические свойства щелочноземельных металлов
Обнаружение ионов металла в солях.
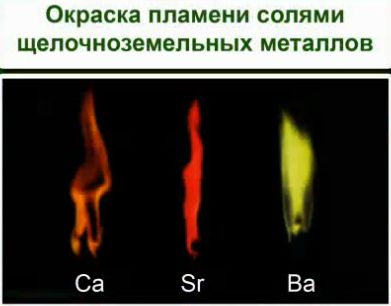
Ионы металлов легко определить по изменению окраски пламени.
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато- зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Металлы - восстановители.
Щелочные и щелочноземельные металлы, как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария  – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
– бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
1. С неметаллами. →
→ 
 →
→
 →
→ 
 →
→
2. Взаимодействие с кислородом. →
→ 
3. Взаимодействие с водой. →
→  ↑, но взаимодействие более спокойное, чем с щелочными металлами.
↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями. (конц) →
(конц) → 
 (конц) →
(конц) →  ↑
↑ 
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов. →
→ 
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария. →
→ 
Применение щелочноземельных металлов
Самыми известными соединениями щелочноземельным металлов являются:  – негашеная известь.
– негашеная известь.  – гашеная известь или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция
– гашеная известь или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция  .Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
.Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает. →
→ 
 ↑ →
↑ →  ↓
↓
 ↓
↓ →
→ 
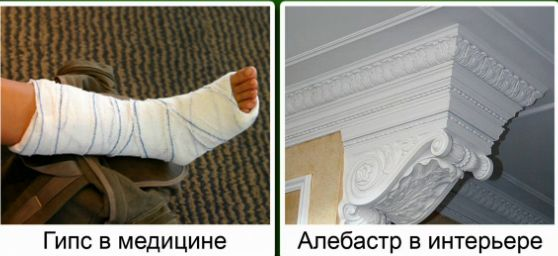
Гипс – это  , алебастр –
, алебастр –  . Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий.
. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий.

Карбонат кальция  образует множество различных минералов.
образует множество различных минералов.
Фосфат кальция  - фосфорит, фосфорная мука используется как минеральное удобрение.
- фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция  – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
– это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция  . Его можно получить
. Его можно получить  →
→ . Одно из его применений – это получение ацетилена.
. Одно из его применений – это получение ацетилена. →
→ ↑
↑

Сульфат бария  – барит. Используется как эталон белого в некоторых исследованиях.
– барит. Используется как эталон белого в некоторых исследованиях.
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния  и
и  . Такую жесткость воды можно устранить кипячением.
. Такую жесткость воды можно устранить кипячением. →
→ ↓
↓  ↑
↑ 
Постоянная жесткость воды обусловлена наличием катионов  ,
,  и анионов
и анионов  и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок. →
→  ↓
↓ 











