Краткий конспект подготовки к ЗНО по химии №3 "Законы в химии. Химические реакции"
Подготовка к ВНО. Химия.
Конспект 3. Законы в химии. Химические реакции.
Химические и физические явления
Все процессы, которые происходят в веществах и между ними можно разделить на химические и физические.
Химические реакции или химические явления – это процессы превращения одних веществ в другие.
При химических реакциях образуются:
1. сложные по составу вещества из более простых,
2. одни сложные вещества переходят в другие,
3. сложные вещества разлагаются на более простые.
Химические явления сопровождаются признаками: физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ. По наличию этих эффектов часто судят о протекании реакций
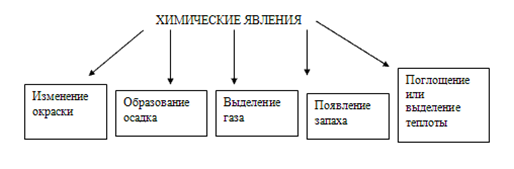
Реакции могут протекать как внутри одного вещества, так и в смесях различных веществ.
Физическое явление – явление, которое не сопровождается образованием новых веществ, оно проявляется в изменении формы тела или агрегатного состояния.

Химические реакции следует отличать от физических процессов, изменяющих только внешнюю форму или агрегатное состояние вещества (но не его состав).
В химии распространены такие физические процессы как прессование, дробление, смешивание, совместное сплавление, растворение, фильтрование осадка, перегонка.
Закон сохранения массы
Современная формулировка закона сохранения массы веществ (был установлен русским ученым М.В. Ломоносовым и французским ученым А. Лоран-де-Лавуазье):
Суммарная масса реагентов равна суммарной массе продуктов реакции.
На атомно-молекулярном уровне закон сохранения массы объясняется тем, что при течении химической реакции происходит только перегруппировка атомов реагентов в молекулы продуктов. Число же атомов каждого элемента и масса каждого атома остаются неизменными до и после реакции.
Уравнения реакций
Химическая реакция изображается в общем виде уравнением реакции.
Уравнение химической реакции – это запись химического явления при помощи формул и коэффициентов.
Исходные вещества – это вещества, взятые для проведения реакции (реагенты).
Продукты реакции – это новые вещества, образовавшиеся в результате протекания реакции.
Пример 1:

реагенты → продукты
Пример 2:
 ↓ +
↓ + 
Пример 3:

Пример 1 и пример 2 – это реакции обмена (протекают без изменения степеней окисления элементов).
Реакции обмена.
Пример 3 – окислительно-восстановительная реакция (с изменением степеней окисления элементов).
Подбор коэффициентов в уравнениях обменных реакций
Подбор коэффициентов проводится поэлементно.
Пример:
__ + __
+ __  = __
= __ ↓ + __
↓ + __ 
Для сохранения числа атомов каждого элемента до и после реакции подбирают дополнительные множители, начиная с самого сложного по составу вещества.
1. В уравнение реакции перед формулой  следует поставить коэффициент 1 (обычно опускается, но подразумевается),
следует поставить коэффициент 1 (обычно опускается, но подразумевается),
2. перед формулой  – коэффициент 2
– коэффициент 2
3. перед формулой  – коэффициент 3:
– коэффициент 3: ↓ + __
↓ + __
4. Затем подбирается коэффициент для  :
:
слева 12 атомов H, а справа 2 атома H, следовательно, множитель 6. Следовательно, перед формулой  ставится коэффициент 6:
ставится коэффициент 6: ↓ +
↓ + 
5. Теперь следует провести проверку по тому элементу, число атомов которого не сравнивалось (Оксиген). Подбор коэффициентов проведен правильно.
Окислительно-восстановительные реакции
Окислением-восстановлением называется передача электронов от атома к атому. Окисляется тот атом, который отдает свои электроны.
Восстанавливается атом принимающий электроны.
Положительно заряженный ион образовался из того элемента, который отдал свои электроны.
Отрицательный ион образовался из элемента, который электроны принял.
Например, натрий активно взаимодействует с хлором (внешне это напоминает горение с выделением белого дыма – очень мелких кристаллов NaCl). В образовавшейся соли  Натрий заряжен положительно, а хлор отрицательно. Следовательно, натрий окислился, а хлор – восстановился. Рис.3.
Натрий заряжен положительно, а хлор отрицательно. Следовательно, натрий окислился, а хлор – восстановился. Рис.3.
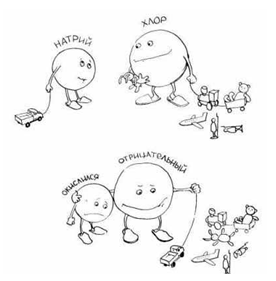
Рис.3 Необычная запись уравнения химической реакции: 
(Хлор – "отрицательный", он отбирает чужие электроны. Натрий "окислился" – это заметно по его кислой мордашке.
Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов.
Повышение степени окисления в ходе реакции, отвечающей потере (отдаче) электронов атомами элемента, называют окислением.
Понижение степени окисления элемента в ходе реакции, отвечающее присоединению ("взятию") электронов атомами этого элемента, называется восстановлением.
Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию восстановителя.
Вещество, частицы которого содержат восстанавливающие атомы, выполняет в реакции функции окислителя.
Подбор коэффициентов в уравнениях окислительно-восстановительных реакций. Метод электронного баланса
В простых уравнениях коэффициенты подбирают поэлементно в соответствии с формулой конечного продукта:
В более сложных уравнениях окислительно-восстановительных реакций подбор коэффициентов проводят методом электронного баланса.
Метод электронного баланса складывается из следующих этапов:
1. Записывают схему реакции (формулы реагентов и продуктов), а затем находят элементы, которые повышают и понижают свои степени окисления, и выписывают их отдельно:


2. Составляют уравнения полу реакций восстановления и окисления, соблюдая законы сохранения числа атомов и заряда в каждой полуреакции:
полу реакция восстановления  ( окислитель)
( окислитель)
полу реакция окисления  ( восстановитель)
( восстановитель)
3. Подбирают дополнительные множители для уравнения полу реакций так, чтобы закон сохранения заряда выполнялся для реакции в целом, для чего число принятых электронов в полу реакциях восстановления делают равным числу отданных электронов в полуреакции окисления:
4. Проставляют (по найденным множителям) стехиометрические коэффициенты в схему реакции (коэффициент 1 опускается): __
__
5. Уравнивают числа атомов тех элементов, которые не изменяют своей степени окисления при протекании реакции (если таких элементов два, то достаточно уравнять число атомов одного из них, а по второму провести проверку). Получают уравнение химической реакции:
6. Проводят проверку по элементу, который не менял свою степень окисления (чаще всего это Оксиген).
Следует подчеркнуть, что подбор коэффициентов не предполагает установления вида продукта; наоборот, вначале составляют схему реакции, то есть устанавливают формулы продуктов, исходя из химических свойств реагентов, а затем подбирают коэффициенты в уравнении реакции.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №3 "Законы в химии. Химическая реакция"











