Краткий конспект подготовки к ЗНО по химии №14 Общие сведения о металлах
Конспект 14. Щелочные металлы
Физические свойства щелочных металлов
Главную подгруппу I группы Периодической системы Д. И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
1.Цвет. Щелочные металлы, кроме Cs, имеют серебристый металлический блеск,
Cs – золотисто-желтую окраску.
2.Твердость. Все щелочные металлы очень мягки, легко режутся (кроме Li), Rb, Cs и Fr при обычной температуре почти пастообразны, наиболее твердый из них Li мягче талька (твердость талька принята за единицу по шкале Мооса).
3.Температура плавления. Щелочные металлы кристаллизуются в кубичической объемноцентрированной решетке. Температуры плавления их уменьшаются от Li к Cs: 180,54 °С (Li), 97,86 °С (Na), 63,51 °С (К), 39,32 °С (Rb), 28,44 °С (Cs).
4.Плотность. Щелочные металлы очень легкие, самый легкий среди всех известных металлов – Li, он плавает в керосине, a Na и К легче воды.
5.Активность. Сильно электроположительный характер и высокая химическая активность щелочных металлов обусловлены небольшой затратой энергии на отрыв от атомов этих металлов одного s-электрона. Щелочные металлы – сильные восстановители.
Электронное строение
Электронные конфигурации валентного слоя щелочных металлов  , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов
, где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов  (s-элементы). У алюминия валентные электроны
(s-элементы). У алюминия валентные электроны  (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
(p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях

Ионы металлов легко определить по изменению окраски пламени.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Соли щелочноземельных металлов: кальция-кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами.
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом, с образованием сульфидов, гидридов, фосфидов.
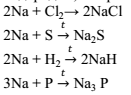
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре. , образующийся нитрид лития подвергается необратимому гидролизу.
, образующийся нитрид лития подвергается необратимому гидролизу. ↑
↑
2. Взаимодействие с кислородом.
Только с литием сразу образуется оксид лития. , а при взаимодействии кислорода с натрием, образуется пероксид натрия.
, а при взаимодействии кислорода с натрием, образуется пероксид натрия. . При горении всех остальных металлов, образуются надпероксиды.
. При горении всех остальных металлов, образуются надпероксиды.
3. Взаимодействие с водой.
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий со вспышкой, а цезий уже с взрывом.  ↑
↑
4. Взаимодействие с кислотами – сильными окислителями. (конц) →
(конц) → 
 (конц) →
(конц) →  ↑ +
↑ + 
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Применение щелочных металлов
Соединения щелочных металлов находят большое применение в разных отраслях промышленности.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
|
Едкий натр (каустическая сода) |
|
|
Чилийская селитра |
|
|
Глауберова соль |
|
|
Сода кристаллическая |
|
|
Едкое кали |
|
|
Хлорид калия (сильвин) |
|
|
Индийская селитра |
|
|
Поташ |



















