Онлайн-урок №1 "Закони в хімії"
Онлайн-урок "Закони в хімії"
02.10.2015 в 18.30
Конспекты к уроку:
Химия – это наука о веществах и их превращениях. Знать свойства веществ необходимо, чтобы:
- найти им применение
- правильно обращаться с ними
- отличать их друг от друга
- узнавать тайны их внутреннего строения.
Простые вещества состоят из атомов одного вида (одного химического элемента):
1. Металлы ( )
)
2. Неметаллы ( )
)
Сложные вещества состоят из атомов разного вида (разных химических элементов) 
Аллотропия – это способность химического элемента образовывать несколько простых веществ.
Атомы и химические элементы
Атом – это наименьшая химическая частица вещества.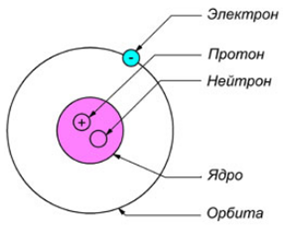
При разрушении атом распадается на более мелкие ("элементарные") физические частицы, из которых он построен. Число этих частиц у разных атомов различное.
Физические частицы – это электрон  , протон
, протон  и нейтрон
и нейтрон  .
.
Химический элемент – вид атомов с одинаковым зарядом ядра.
Относительная атомная масса
Атомы элементов характеризуются определённой (только им присущей) массой, поэтому введено понятие об
относительной атомной массе  − отношении массы атома данного элемента к атомной единице массы (
− отношении массы атома данного элемента к атомной единице массы ( г).
г).
Молекулы. Молекулярные формулы
Молекула – наименьшая частица вещества, сохраняющая химические свойства этого вещества. Все молекулы построены из атомов и поэтому также электронейтральны.
Молекулярная формула отражает и качественный состав вещества (символы химических элементов, входящих в его молекулу), и его количественный состав (нижние числовые индексы, отвечающие числу атомов каждого элемента в молекуле).
Индекс – это цифра, которая записывается внизу справа от символа химического элемента. Индекс показывает число атомов данного химического элемента.

Коэффициент – это цифра, которая записывается перед формулой вещества. И означает число отдельных частиц веществанта в формуле вещества.

Относительная молекулярная масса  – отношение массы одной молекулы вещества до 1/12 массы атома 12С. Находится как сумма относительных атомных масс, которые входят в состав молекулы.
– отношение массы одной молекулы вещества до 1/12 массы атома 12С. Находится как сумма относительных атомных масс, которые входят в состав молекулы.
Количество вещества
Количество вещества – физическая величина, которая показывает число структурных частиц вещества.

n – количество вещества [моль],
m – масса [г]
V – объем [л]
N – число структурных частиц [атомов, молекул, ионов]
M – молярна масса [г/моль], |M| = | |
|
 – молярний объем [л/моль],
– молярний объем [л/моль], 
 – число Авогадро [моль
– число Авогадро [моль ],
],  .
.
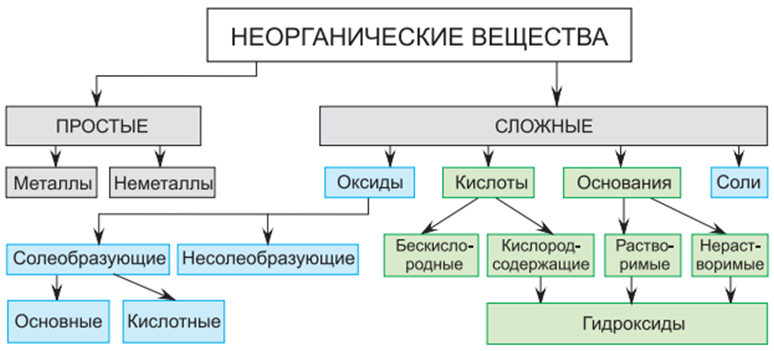
Классификация неорганических веществ
Простые вещества делятся на металлы и неметаллы. Такое деление основано, прежде всего, на их физических и химических свойствах.
Металлы обладают ярко выраженными физическими свойствами. Они непрозрачны, имеют характерный блеск, электропроводны, теплопроводны. Металлы пластичны, т.е. не дробятся как хрупкие вещества, например, стекло, а расплющиваются.
Неметаллы отличаются разнообразием физических свойств.
Среди них есть газообразные вещества ( , инертные газы
, инертные газы  ), твердые легкоплавкие (
), твердые легкоплавкие ( ) и тугоплавкие (алмаз, графит, кремний) вещества, и жидкости (бром).
) и тугоплавкие (алмаз, графит, кремний) вещества, и жидкости (бром).
Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Явление аллотропии обусловлено в одних случаях тем, что молекулы простого вещества состоят из различного числа атомов ( ), в других – тем, что их кристаллы имеют различное строение (алмаз, графит, карбин).
), в других – тем, что их кристаллы имеют различное строение (алмаз, графит, карбин).
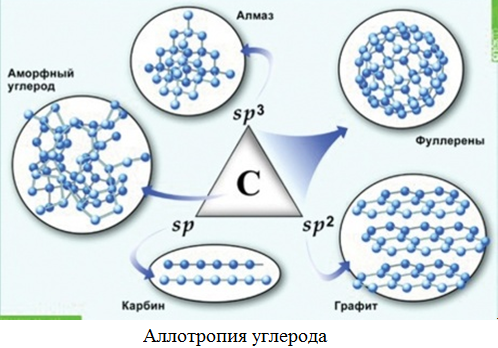
Аллотропные модификации характерны для кислорода, серы, углерода, фосфора, кремния, олова, мышьяка и других химических элементов.
Классификация сложных веществ
В химии важно построить такую классификацию, веществ, которая бы помогла сориентироваться в их химических свойствах.
Сложные вещества подразделяются на четыре класса химических соединений:
1. оксиды,
2. основания,
3. кислоты,
4. соли.
Оксиды. В составе любого оксида всегда два элемента, один из которых кислород.
Внутри класса выделяют группы, называемые основными ( и др.) и кислотными (
и др.) и кислотными ( и др.) и несолеобразующими (
и др.) и несолеобразующими ( ) оксидами.
) оксидами.
Основания. Каждому основному оксиду соответствует основание – вещество, состоящее из металла и гидроксогруппы. Основания в зависимости от растворимости в воде подразделяют на щёлочи ( ) и нерастворимые в воде основания (
) и нерастворимые в воде основания ( ). Такое подразделение важно, так как, несмотря на сходство состава, у щелочей и нерастворимых оснований много различий в свойствах.
). Такое подразделение важно, так как, несмотря на сходство состава, у щелочей и нерастворимых оснований много различий в свойствах.
Кислоты. Каждому кислотному оксиду соответствует кислородосодержащая кислота, в состав которой входит водород и кислотный остаток. ( ) Среди кислот встречаются и бескислородные кислоты (
) Среди кислот встречаются и бескислородные кислоты ( ).
).
Соли. При взаимодействии веществ, имеющих противоположные свойства, например кислотного и основного оксида, кислоты и основания, получаются соли – вещества, состоящие из металла и кислотного остатка ( ).
).
Есть неорганические вещества, которые не относятся ни к одному из упомянутых классов, например, гидриды металлов, нитриды, карбиды:  .
.
Количественные расчёты в химии
Количественные расчеты в химии ведут по формулам веществ (чтобы найти количественный состав сложного вещества, массовые доли элементов в нём) и уравнениям реакций (чтобы определить мольные, массовые и объёмные отношения между реагентами и продуктами). Такие расчеты называют стехиометрическими.

Относительная молекулярная масса. Количество вещества.
Число Авогадро
Относительная молекулярная масса  – отношение массы молекулы к атомной единице массы (
– отношение массы молекулы к атомной единице массы ( г). Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества.
г). Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества.
Количество вещества n – это физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого вещества.

Молярная масса
Количество вещества 1 моль, то есть порция, обязательно содержащая  частиц, обладает определенной массой, характерной для данного вещества – молярной массой (обозначение М).
частиц, обладает определенной массой, характерной для данного вещества – молярной массой (обозначение М).
Молярную массу вещества  можно определить как отношение массы данной порции вещества
можно определить как отношение массы данной порции вещества  к количеству вещества
к количеству вещества  в этой порции:
в этой порции:

Единица измерения молярной массы: г/моль.
Массовая доля элемента в сложном веществе
По известной химической формуле сложного вещества определяют массовые доли элементов, входящих в это вещество.
Массовая доля элемента  в общей массе сложного вещества – это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого):
в общей массе сложного вещества – это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого):

Массовая доля элемента – это доля от единицы или от 100%. В сложном веществе  всегда меньше единицы (или меньше 100%).
всегда меньше единицы (или меньше 100%).
Например, для воды 
 (11%) и
(11%) и  (89%). Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%).
(89%). Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%).
Закон Авогадро. Молярный объем газа. Относительная плотность газа

Первое следствие из закона Авогадро:
При одинаковых условиях равные количества различных газов занимают равные объёмы.
В частности, при нормальных условиях (н. у.) – температуре  (
( ) и давлении
) и давлении  Па (1 атм, 760 мм. рт. ст.) – 1 моль любого газа (близкого по свойствам к идеальному газу), занимает объём 22,4 л.
Па (1 атм, 760 мм. рт. ст.) – 1 моль любого газа (близкого по свойствам к идеальному газу), занимает объём 22,4 л.
Эта физическая постоянная – молярный объём газа при нормальных условиях.
Молярный объём газа  равен отношению объёма порции газа В:
равен отношению объёма порции газа В:  к количеству вещества в этой порции
к количеству вещества в этой порции  :
:

Единица измерения молярного объёма газа: л/моль. При нормальных условиях  = 22,4 л/моль.
= 22,4 л/моль.
Из определения для  следует, что
следует, что

Это выражение позволяет рассчитывать по массе газа его объем.
Второе следствие из закона Авогадро:
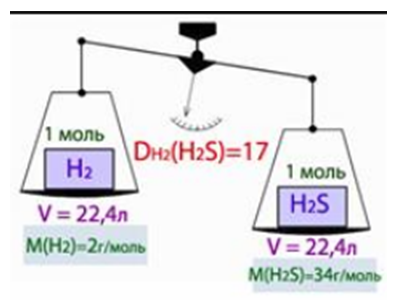
Молярная масса вещества в газообразном состоянии равна его удвоенной относительной плотности по водороду:
 .
.
Аналогичным образом, с учетом средней молярной массы воздуха  г/моль:
г/моль:
Относительная плотность по водороду  , по воздуху
, по воздуху  и по любому другому газу определяется экспериментально, что позволяет рассчитать молекулярную массу газа.
и по любому другому газу определяется экспериментально, что позволяет рассчитать молекулярную массу газа.
Все процессы, которые происходят в веществах и между ними можно разделить на химические и физические.
Химические реакции или химические явления – это процессы превращения одних веществ в другие.
При химических реакциях образуются:
1. сложные по составу вещества из более простых,
2. одни сложные вещества переходят в другие,
3. сложные вещества разлагаются на более простые.
Химические явления сопровождаются признаками: физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ. По наличию этих эффектов часто судят о протекании реакций
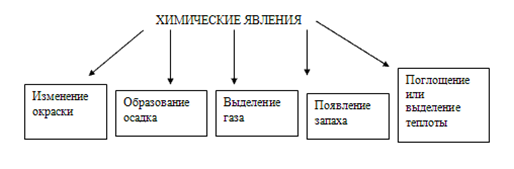
Реакции могут протекать как внутри одного вещества, так и в смесях различных веществ.
Физическое явление – явление, которое не сопровождается образованием новых веществ, оно проявляется в изменении формы тела или агрегатного состояния.

Химические реакции следует отличать от физических процессов, изменяющих только внешнюю форму или агрегатное состояние вещества (но не его состав).
В химии распространены такие физические процессы как прессование, дробление, смешивание, совместное сплавление, растворение, фильтрование осадка, перегонка.
Закон сохранения массы
Современная формулировка закона сохранения массы веществ (был установлен русским ученым М.В. Ломоносовым и французским ученым А. Лоран-де-Лавуазье):
Суммарная масса реагентов равна суммарной массе продуктов реакции.
На атомно-молекулярном уровне закон сохранения массы объясняется тем, что при течении химической реакции происходит только перегруппировка атомов реагентов в молекулы продуктов. Число же атомов каждого элемента и масса каждого атома остаются неизменными до и после реакции.
Уравнения реакций
Химическая реакция изображается в общем виде уравнением реакции.
Уравнение химической реакции – это запись химического явления при помощи формул и коэффициентов.
Исходные вещества – это вещества, взятые для проведения реакции (реагенты).
Продукты реакции – это новые вещества, образовавшиеся в результате протекания реакции.
Пример 1:

реагенты → продукты
Пример 2:
 ↓ +
↓ + 
Пример 3:

Пример 1 и пример 2 – это реакции обмена (протекают без изменения степеней окисления элементов).
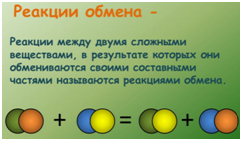
Реакции обмена.
Пример 3 – окислительно-восстановительная реакция (с изменением степеней окисления элементов).
Подбор коэффициентов в уравнениях обменных реакций
Подбор коэффициентов проводится поэлементно.
Пример:
__ + __
+ __  = __
= __ ↓ + __
↓ + __ 
Для сохранения числа атомов каждого элемента до и после реакции подбирают дополнительные множители, начиная с самого сложного по составу вещества.
1. В уравнение реакции перед формулой  следует поставить коэффициент 1 (обычно опускается, но подразумевается),
следует поставить коэффициент 1 (обычно опускается, но подразумевается),
2. перед формулой  – коэффициент 2
– коэффициент 2
3. перед формулой  – коэффициент 3:
– коэффициент 3: ↓ + __
↓ + __
4. Затем подбирается коэффициент для  :
:
слева 12 атомов H, а справа 2 атома H, следовательно, множитель 6. Следовательно, перед формулой  ставится коэффициент 6:
ставится коэффициент 6: ↓ +
↓ + 
5. Теперь следует провести проверку по тому элементу, число атомов которого не сравнивалось (Оксиген). Подбор коэффициентов проведен правильно.
Окислительно-восстановительные реакции
Окислением-восстановлением называется передача электронов от атома к атому. Окисляется тот атом, который отдает свои электроны.
Восстанавливается атом принимающий электроны.
Положительно заряженный ион образовался из того элемента, который отдал свои электроны.
Отрицательный ион образовался из элемента, который электроны принял.
Например, натрий активно взаимодействует с хлором (внешне это напоминает горение с выделением белого дыма – очень мелких кристаллов NaCl). В образовавшейся соли  Натрий заряжен положительно, а хлор отрицательно. Следовательно, натрий окислился, а хлор – восстановился. Рис.3.
Натрий заряжен положительно, а хлор отрицательно. Следовательно, натрий окислился, а хлор – восстановился. Рис.3.
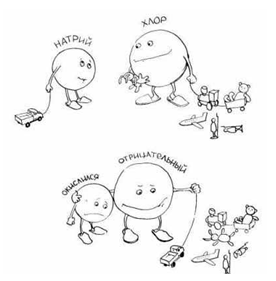
Рис.3 Необычная запись уравнения химической реакции: 
(Хлор – "отрицательный", он отбирает чужие электроны. Натрий "окислился" – это заметно по его кислой мордашке.
Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов.
Повышение степени окисления в ходе реакции, отвечающей потере (отдаче) электронов атомами элемента, называют окислением.
Понижение степени окисления элемента в ходе реакции, отвечающее присоединению ("взятию") электронов атомами этого элемента, называется восстановлением.
Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию восстановителя.
Вещество, частицы которого содержат восстанавливающие атомы, выполняет в реакции функции окислителя.
Подбор коэффициентов в уравнениях окислительно-восстановительных реакций. Метод электронного баланса
В простых уравнениях коэффициенты подбирают поэлементно в соответствии с формулой конечного продукта:
В более сложных уравнениях окислительно-восстановительных реакций подбор коэффициентов проводят методом электронного баланса.
Метод электронного баланса складывается из следующих этапов:
1. Записывают схему реакции (формулы реагентов и продуктов), а затем находят элементы, которые повышают и понижают свои степени окисления, и выписывают их отдельно:


2. Составляют уравнения полу реакций восстановления и окисления, соблюдая законы сохранения числа атомов и заряда в каждой полуреакции:
полу реакция восстановления  ( окислитель)
( окислитель)
полу реакция окисления  ( восстановитель)
( восстановитель)
3. Подбирают дополнительные множители для уравнения полу реакций так, чтобы закон сохранения заряда выполнялся для реакции в целом, для чего число принятых электронов в полу реакциях восстановления делают равным числу отданных электронов в полуреакции окисления:
4. Проставляют (по найденным множителям) стехиометрические коэффициенты в схему реакции (коэффициент 1 опускается): __
__
5. Уравнивают числа атомов тех элементов, которые не изменяют своей степени окисления при протекании реакции (если таких элементов два, то достаточно уравнять число атомов одного из них, а по второму провести проверку). Получают уравнение химической реакции:
6. Проводят проверку по элементу, который не менял свою степень окисления (чаще всего это Оксиген).
Следует подчеркнуть, что подбор коэффициентов не предполагает установления вида продукта; наоборот, вначале составляют схему реакции, то есть устанавливают формулы продуктов, исходя из химических свойств реагентов, а затем подбирают коэффициенты в уравнении реакции.
Тесты к уроку:
Вступительный онлайн-тест ЗНО по химии
Online-тест подготовки к ЗНО по химии №1 "Неорганическая и органическая химия"
Online-тест подготовки к ЗНО по химии №2 "Основные химические понятия. Вещество"












