Онлайн-урок №30 "Амінокислоти. Білки. Решение комплексних тестов"
Онлайн-урок №30 "Амінокислоти. Білки. Решение комплексних тестов"
27.05.2016 в 18.30
Конспекти до уроку:
Аминокислоты – это органические соединения, молекулы которых содержат и карбоксильную группу  , и аминогруппу
, и аминогруппу  .
. 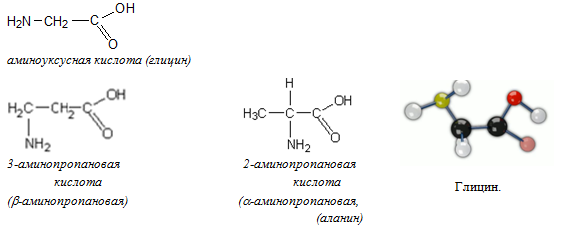
В состав белков входят только аминокислоты, в которых аминогруппа и карбоксильная группа находятся у одного и того же атома углерода (α-аминокислоты).
Общая формула природных аминокислот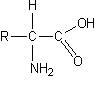
Примеры некоторых природных α-аминокислот
| Глицин |  |
Gly |
| Аланин |  |
Ala |
| Аспарагиновая кислота |  |
Asp |
| Цистеин |  |
Cys |
| Лизин |  |
Lys |
| Тирозин |  |
Tyr |
| Глутаминовая кислота |  |
Glu |
Обратите внимание, что молекулы природных аминокислот могут включать и другие функциональные группы.
Амфотерность аминокислот
Амфотерность – это способность одного вещества проявлять как кислотные, так и основные свойства.
В молекуле аминокислоты присутствуют одновременно оснóвная группа (аминогруппа) и кислотная группа (карбоксильная группа). Эти группы взаимодействуют друг с другом, как кислота с основанием, и образуется внутренняя соль:
Поэтому аминокислоты похожи по физическим свойствам на соли: это твердые, кристаллические вещества, растворимые в воде. Среда растворов нейтральная.
Все ли аминокислоты нейтральны? Строго говоря, нет. Например, раствор лизина имеет основную среду, а раствор глутаминовой кислоты – кислотную: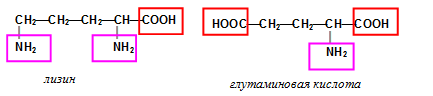
Будучи амфотерными, аминокислоты могут взаимодействовать и с кислотами, и с основаниями с образованием солей:
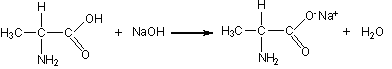
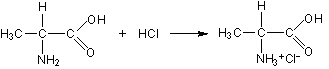
Образование пептидов
Пептидная связь – полярная ковалентная связь между атомом углерода группы  и атомом азота группы
и атомом азота группы  двух разных α-аминокислот.
двух разных α-аминокислот.
Пептид – вещество, состоящее из остатков α-аминокислот, соединенных пептидными связями.
В определенных условиях от аминогруппы одной молекулы и карбоксильной группы другой молекулы отщепляется молекула воды, и два остатка аминокислот соединяются пептидной связью: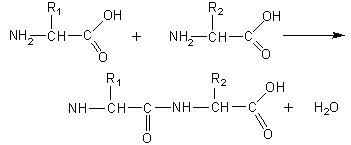
На концах получившейся молекулы (дипептида) – свободные аминогруппа и карбоксильная группа. Они могут реагировать с другими аминокислотами, образуя трипептиды, тетрапептиды… полипептиды.
Дипептид – вещество, состоящее из остатков двух аминокислот, соединенных пептидными связями.
Полипептид – полимер, состоящий из остатков аминокислот, соединенных пептидными связями.
В общем случае (не только для α-аминокислот) связь, которой соединены остатки аминокислот, носит название амидной связи. Синтетические аминокислоты применяют в промышленности для получения полиамидов, идущих на изготовление волокон и тканей. Например, всем известный полимер капрон образован из ε-аминокапроновой кислоты  :
:
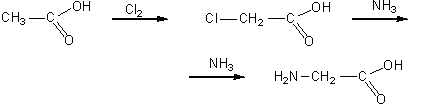
Получение аминокислот.
1. Гидролиз белков
2. Получение глицина:
Белки – это природные полимеры, построенные из остатков аминокислот.
Гидролиз белков
Пептидная связь гидролизуется в кислой или щелочной среде. При этом образуются соли аминокислот по карбоксильной группе или по аминогруппе.
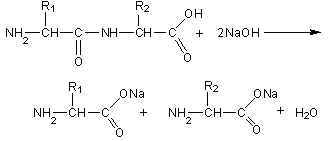
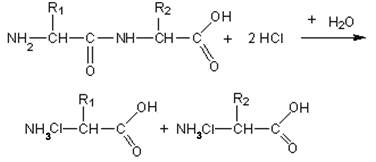
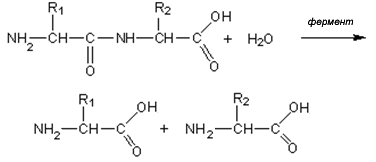
Белки гидролизуются и под действием ферментов
Функции белков в организме
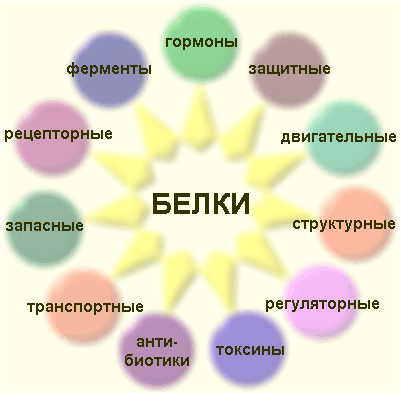
Функции белков в организме.
Строение белков
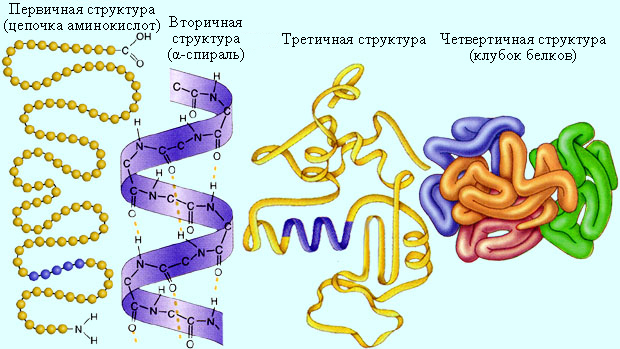
Первичная структура белка – это последовательность аминокислотных остатков.
Вторичная структура белка – расположение полипептидной цепи в пространстве, обусловленное водородными связями между атомом кислорода карбоксильной группы и атомом водорода аминогруппы разных аминокислотных остатков.
Третичная структура белка – расположение вторичной структуры в пространстве, обусловленное дополнительными взаимодействиями между различными участками полипептидной цепи.
Четвертичная структура белка – объединение нескольких полипептидных цепей в один белок.
Например, гемоглобин состоит из 4 пептидных цепочек, каждая из которых содержит по 140 остатков аминокислот.
Химические свойства белков
1. Денатурация белка
Денатурация – разрушение вторичной, третичной и четвертичной структуры белка при различных воздействиях (нагревании, действии растворителей, иногда даже при энергичном встряхивании). Первичная структура при этом не разрушается.
При снятии неблагоприятных воздействий наступает – ренатурация – восстановление до четвертичной структуры.
Деструкция – полное разрушение, затрагивающее даже первичную структуру.
Деструкция происходит при варке яйца, скисании молока.
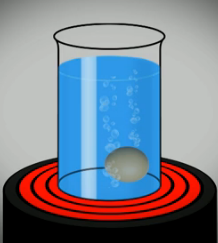
2. Качественные реакции на белок
А. При нагревании белки разлагаются с выделением летучих продуктов, издавая характерный запах жженых перьев.
Б. Ксантопротеиновая реакция – пожелтение белка при действии концентрированной азотной кислоты (окраска появляется за счет нитрования бензольных колец, входящих в состав остатков ароматических аминокислот).
В. Биуретовая реакция – окрашивание в ярко-фиолетовый цвет при действии раствора соли меди(II) в щелочной среде – обусловлена образованием комплексов иона меди(II) с боковыми аминогруппами.
Качественные, т.е. нерасчетные задачи можно условно разделить на несколько типов.
I. Задачи на объяснение фактов или тенденций
Задача 1.
Условие задачи. Согласно справочным данным, фенол представляет собой бесцветные прозрачные кристаллы. Тем не менее химический реактив фенол, стоящий в банке на полке, всегда окрашен в розовый цвет. Почему?

Решение.
Вспомним особенности строения фенола.
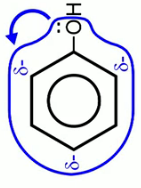
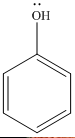
Поскольку – это бензольное кольцо, к которому присоединен атом заместителя кислорода, содержащего неподеленную электронную пару, то происходит взаимодействие электронов кислорода и бензольного кольца.
В результате происходит соряжение π-электронов бензольного кольца и электронной пары атома кислорода. Активность всего бензольного кольца сущетвенно возрастает. Получается вещество гораздо менне устойчиво к окислению по сранению с исходным бензолом.
Поэтому фенол всегда загрязнен продуктами окисления, имеющими яркую окраску. В результате, он имеет характерный розовый цвет.
II. Задачи на сравнение свойств веществ
Задача 1.
Условие задачи. Как изменятся свойства уксусной кислоты, при замене водородов в метильном радикале на атомы хлора:  →
→  →
→  →
→  ?
?
Решение.
При замещении водорода хлором, хлор как более электроотрицательный атом стягивает на себя электронную плотность.
Эта электронная плотность смещается от карбоксильной группы и соответственно от карбоксильного атома водорода  <
<  <
<  <
<
Атом водорода приобретает более положительный заряд. Уксусная кислота с заменой водорода на хлор в своем углеводородном радикале становится более легко диссоциирующей.
У нее становится более высокая константа диссоциации по сравнению с исходной уксусной кислотой. <
<  <СНCl2-СООН< СCl3-СООН
<СНCl2-СООН< СCl3-СООН
Трихлоруксусная кислота  уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
III. Задачи на качественный анализ органических соединений
Задача 1.
Условие задачи. Соединение А – легкокипящая жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода. Плотность паров одного из этих соединений В – лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди (II) в вещество С, которое используется для сохранения биологических препаратов.
Приведите возможные формулы веществ А, В, С.
Решение.
То, что могло быть окислено оксидом меди (II), является альдегидом. →
→ 
Делаем предположение: вещество С – альдегид. При этом данный альдегид используется для хранения биологических препаратов. Биологические препараты хранят в растворе формалина. Вещество – С – формальдегид (метаналь)  .
.
Формальдегид получился из метанола. Значит, вещество В – это метанол. →
→ 
Метанол  немного тяжелее воздуха.
немного тяжелее воздуха.  = 32 г/моль,
= 32 г/моль,  (воздуха) = 29 г/моль.
(воздуха) = 29 г/моль.
Поскольку при гидролизе исходного вещества получились два вещества с одинаковым числом атомов углерода  →
→  , то кислота с одним атомом углерода – это
, то кислота с одним атомом углерода – это  – муравьиная кислота.
– муравьиная кислота.
Исходное вещество А – с приятным запахом – это  – метиловый эфир муравьиной кислоты.
– метиловый эфир муравьиной кислоты.
Ответ: А -  ; В -
; В -  ; С – формальдегид
; С – формальдегид  .
.
IV. Задачи на различение веществ
Задача 1.
Условие задачи. В трех пробирках находятся три водных раствора: муравьиной кислоты НCOOH, соляной кислоты HCl и этанола C2H5-OH.Как, используя минимальное количество реактивов различить вещества в пробирках?
Решение.
1. Во все три пробирки добавляем индикатор, например, метилоранж. В растворах кислот, он изменит свой цвет на красный.
В оставшейся пробирке – этанол  .
.
2. Муравьиная кислота  является еще и альдегидом. Действуем на обе кислоты щелочным раствором
является еще и альдегидом. Действуем на обе кислоты щелочным раствором  .
. ↓
↓ →
→  ↓
↓  ↑
↑
 ↓ - осадок красного цвета.
↓ - осадок красного цвета.
3. В пробирке с соляной кислотой HCl синий осадок  ↓ просто растворится.
↓ просто растворится. ↓
↓ →
→  ↓
↓
Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии №47 "Аминокислоты"
Онлайн-тест подготовки к ЗНО по химии №48 "Белки"
Онлайн-тест подготовки к ЗНО по химии №50 "Обобщение сведений об органических соединениях"
Онлайн-тест подготовки к ЗНО по химии №51 "Повторение органической химии"
Онлайн-тест подготовки к ЗНО по химии №52 "Срез 3"
Онлайн-тест подготовки к ЗНО по химии №56 "Решение общих вариантов ВНО"
Онлайн-тест подготовки к ЗНО по химии №57 "Решение общих вариантов ВНО №2"
Онлайн-тест подготовки к ЗНО по химии №58 "Решение общих вариантов ВНО №3"
Онлайн-тест подготовки к ЗНО по химии №59 "Решение общих вариантов ВНО №4"
Онлайн-тест подготовки к ЗНО по химии №60 "Решение общих вариантов ВНО №5"
Корисні посилання:
Ксантопротеиновая реакция на белки












