Онлайн-урок №24 "Одноатомні та багатоатомна спирти. Феноли"
Онлайн-урок №24 "Одноатомные и многоатомные спирты. Феноли"
9.04.2016 в 17.00
Конспекти до уроку:
Спирты – производные углеводородов, в которых один или несколько атомов водорода заменены на функциональную группу –OH (гидроксил): R-OH
 метан →
метан →  метиловый спирт
метиловый спирт этан →
этан →  этиловый спирт
этиловый спирт
Название спирта образуется от названия предельного углеводорода с прибавлением окончания -ол. Например,  – метанол,
– метанол,  – этанол,
– этанол,
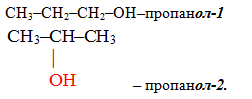
Выбор главной цепи:
1. Главная цепь включает гидроксил.
2. Главная цепь нумеруется так, чтобы атом углерода с гидроксилом получил наименьший номер.
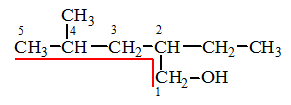
4-метил-2-этилпентанол-1
Одноатомный спирт – спирт, молекула которого содержит одну гидроксильную группу.
Пример: 
Многоатомный спирт – спирт, молекула которого содержит две или более гидроксильные группы.
Пример: 
Количество гидроксильных групп в молекуле отражается в названии частицами ди-, три-, тетра- и т. д., поставленными перед суффиксом -ол.
пропантриол-1,2,3 (глицерин).
Физические свойства спиртов
1. Температуры плавления и кипения спиртов, так же как и углеводородов, увеличиваются с ростом числа атомов углерода в молекуле, но их значения у спиртов намного больше, чем у соответствующих алканов.
Причина – водородные связи между молекулами спиртов:
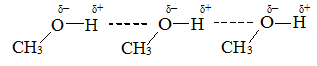
 2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях.
2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях.
С увеличением углеводородного радикала растворимость в воде постепенно уменьшается.
3. Низшие спирты обладают характерным запахом. Например, кошачий запах связан с тем, что в этот запах основным компонентом входит изопропиловый спирт.
Химические свойства спиртов
У всех спиртов есть одинаковый признак – это наличие гидроксильной группы. Эта гидроксогруппа делает спирты в какой-то степени подобной воде. Сходство строения Сходство строения спиртов и воды обусловливает сходство химических свойств, из-за гидроксильной группой – ОН.
Реакция со щелочными металлами:
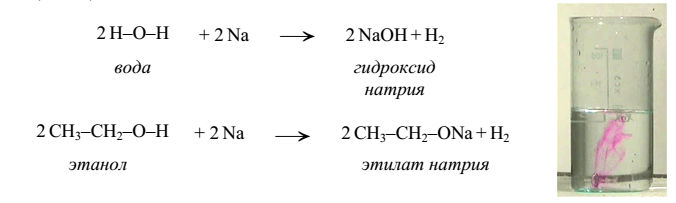
Спирт и вода в реакциях с натрием отдают ион водорода, т.е. в данной реакции они проявляют кислотные свойства. Продукт реакции спирта с натрием – соль.
Общее название солей спиртов – алкоголяты. Реакции спиртов со щелочными металлами довольно широко используется в лабораторной практике. Остатки щелочных металлов опасно уничтожать, вводя их в реакцию с водой, поскольку вода очень активно взаимодействует с ними. Поэтому чаще всего для этих целей используют этиловый спирт.
Реакция со щелочами:
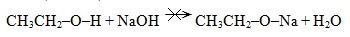
Реакция не идет!
Причина: спирт – более слабая кислота, чем вода, и не может вытеснить воду.
Многоатомные спирты
Многоатомные спирты – соединения, у которых две или несколько гидроксильных групп расположены у соседних атомов углерода.
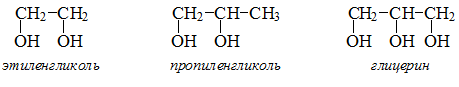
Свойства многоатомных спиртов
- 1. Общие свойства с другими спиртами:
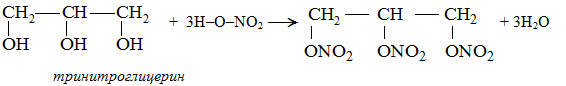
Например, образование сложных эфиров при взаимодействии с кислотами:
Или кислотные свойства:
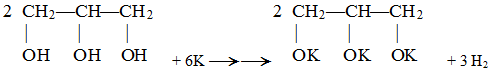
2. Особенные:
1. Соединения, у которых рядом расположено несколько гидроксильных групп, сладкие на вкус. Глицерин добавляют в ликеры и конфетные начинки в качестве загустителя.
2. Взаимодействие с гидроксидом меди – качественная реакция на многоатомные спирты. Получается прозрачный раствор комплексного соединения интенсивного синего цвета: глицерата меди.
Фенолы – соединения, в которых гидроксильная группа присоединена к бензольному кольцу.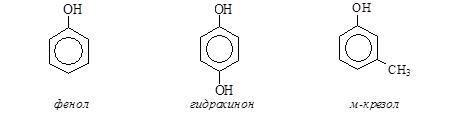
Фенол – твердое бесцветное вещество с характерным запахом гуашевых красок, немного растворимое в воде.
Особенности строения фенола
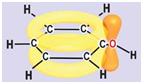
Не поделённая пара электронов кислорода вступает во взаимодействие с электронным облаком бензольного кольца. Рис.2. В итоге электронная плотность «размазана» не по шести, а по семи атомам, причем электронная пара кислорода как бы «втянута» в бензольное кольцо:
Особенности строения фенола.
Химические свойства фенола
1. Проявление влияния бензольного кольца на ОН-группу:
Связь О-Н становится полярнее, отсюда следует:
1. Сильнее межмолекулярное взаимодействие → выше Тпл, Ткип
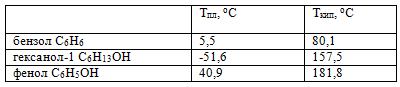
2. Легче диссоциация → сильнее кислотные свойства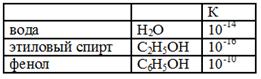
В отличие от спиртов, фенол реагирует со щелочами: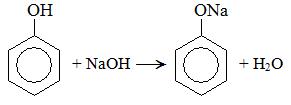
2. Проявление влияния ОН-группы на бензольное кольцо:
Электронная плотность в кольце повышена →
1. Фенол вступает в реакции замещения легче, чем бензол. Замещение идет в орто- и пара-положения.
Например, для бромирования бензола обязательно берется сухой бром и катализатор, а реакция бромирования фенола происходит просто при добавлении бромной воды: образуется белый осадок-2,4,6-трибромфенол.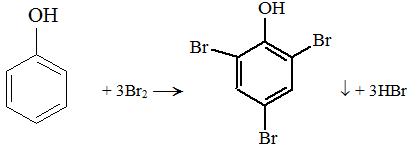
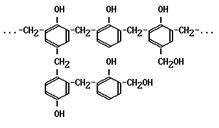
2. Легкое окисление фенола (на воздухе приобретает розовую окраску, образуя полифенолы).
Применение фенола
А. Получение полимеров, в том числе фенолформальдегидных смол:
Б. Получение искусственных волокон, лекарств, пестицидов.
В. Антисептик.
Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии №39 "Спирты"
Онлайн-тест подготовки к ЗНО по химии №40 "Фенолы"
Корисні посилання:
Качественная реакция на многоатомные спирты












