Онлайн-урок №20 "Алкани"
Онлайн-урок №20 "Алканы"
11.03.2016 в 18.30
Конспекти до уроку:
Разделение химии как науки на органическую химию и неорганическую
К началу XXI века химики выделили в чистом виде миллионы веществ. При этом известно более 18 миллионов соединений углерода и меньше миллиона соединений всех остальных элементов. Количество органических соединений с каждым годом становится все больше.
Вещества стали разделять на органические и неорганические с начала XIX века. В то время органическими называли вещества, выделенные из животных и растений. Неорганическими веществами считали вещества, полученные из минералов. Вещества, содержащие углерод, выделенные из органических объектов стали называть органическими. Соединения углерода в основном относят к органическим соединениям.
Именно через органический мир проходит основная часть круговорота углерода в природе.
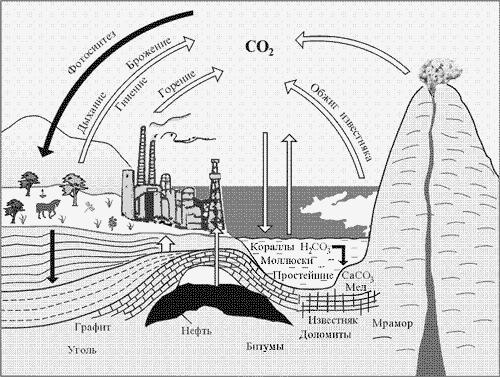
Вещества, содержащие углерод в неорганической химии.
Из соединений, содержащих углерод, к неорганическим веществам традиционно относят графит, алмаз, оксиды углерода ( и
и  ), угольную кислоту (
), угольную кислоту ( ), карбонаты (например, карбонат натрия – сода
), карбонаты (например, карбонат натрия – сода  ), карбиды (карбид кальция
), карбиды (карбид кальция  ), цианиды (цианистый калий
), цианиды (цианистый калий  ), роданиды (роданистый натрий
), роданиды (роданистый натрий  ).
).
Что такое органические соединения
Более точное современное определение: органические соединения – это углеводороды и их производные. Простейший углеводород – это метан  . В нем атомы водорода соединены ковалентными связями с 4 атомами водорода. Следующий по сложности – этан
. В нем атомы водорода соединены ковалентными связями с 4 атомами водорода. Следующий по сложности – этан . Если атом водорода заместить на группу
. Если атом водорода заместить на группу  , то получится вещество метанол или метиловый спирт
, то получится вещество метанол или метиловый спирт  . Если заместить на на группу
. Если заместить на на группу  , получим метиламин
, получим метиламин  .
. 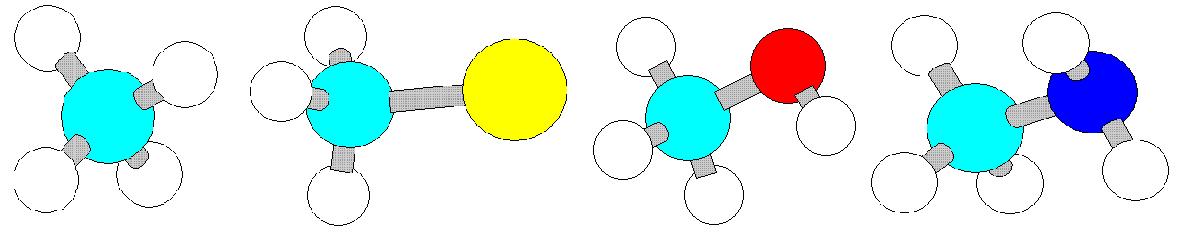
Модели производных метана  , хлорметана
, хлорметана  , метилового спирта
, метилового спирта  , метиламина
, метиламина  .
.
В состав органических соединений, кроме атомов углерода и водорода, могут входить атомы кислорода, азота, серы, фосфора, реже галогенов. Эти химические элементы в органической химии называются органогены.
Причины многообразия органических веществ
Органических веществ так много из-за особенностей образования химических связей атомами углерода. Эти небольшие атомы способны образовывать прочные ковалентные связи друг с другом и с неметаллами-органогенами.
В молекуле этана  друг с другом связаны 2 атома углерода, в молекуле пентана
друг с другом связаны 2 атома углерода, в молекуле пентана  – 5 атомов, а в молекуле всем известного полиэтилена сотни тысяч атомов углерода.
– 5 атомов, а в молекуле всем известного полиэтилена сотни тысяч атомов углерода.
Современные формулировки основных положений теории химического строения
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. В настоящее время используются также физические методы.
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Порядок составления названия органического вещества
1. В структурной формуле выбирают основную цепь, используя алгоритм выбора основной цепи.
2. Основную цепь нумеруют так, чтобы старшая характеристическая группа получила наименьший номер. Если такая группа отсутствует, наименьший номер получает кратная связь, причем принято, что двойная связь старше тройной. В случае отсутствия кратных связей нумерацию проводят так, чтобы заместители получили наименьшие номера.
3. Перечисляют заместители с их номерами в алфавитном порядке, затем записывают корень названия, отвечающий числу атомов углерода в основной цепи, добавляют суффикс кратных связей и суффикс старшей характеристической группы.
4. Если в молекуле присутствует несколько одинаковых заместителей или кратных связей, то употребляют приставку, обозначающую их число (ди-, три-, тетра-, пента-, гекса- и т.д.). Числа в названиях отделяют дефисами, между числами ставят запятые.
Гомологический ряд алканов
Алканы (предельные или насыщенные углеводороды, парафины) – углеводороды, атомы углерода в которых соединены простыми связями. Общая формула:  .
.
Соотношение числа атомов водорода и углерода в молекулах алканов максимально по сравнению с молекулами углеводородов других классов.
Поскольку, все валентности углерода заняты либо углеродами, либо водородами, как правило, химические свойства алканов не очень ярко выражены, поэтому их еще называют предельными или насыщенными углеводородами. И существует еще более древнее название, лучше отражающее их относительную, конечно, химическую инертность – парафины, что переводится как «лишенные сродства».
Строение молекул
Атомы углерода в алканах находятся в состоянии  – гибридизации, и молекулу алканов можно представить как набор тетраэдрических структур углерода, связанных между собой и с водородам.
– гибридизации, и молекулу алканов можно представить как набор тетраэдрических структур углерода, связанных между собой и с водородам.
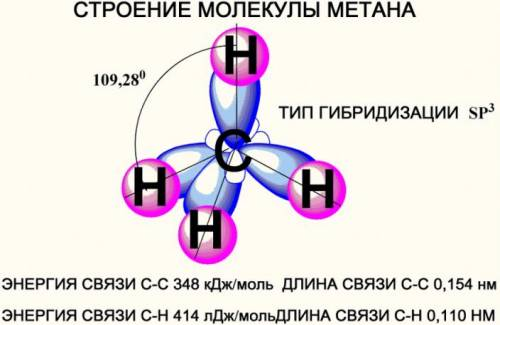
Тетраэдрическое строение метана
 -связи между атомами
-связи между атомами  и
и  прочные, практически неполярные (очень мало полярные).
прочные, практически неполярные (очень мало полярные).
Атомы вокруг простых связей постоянно вращаются. Поэтому молекулы алканов могут принимать разные формы. При этом длина связи и угол между связями остаются постоянными. Формы, переходящие друг в друга за счет вращения молекулы вокруг  -связей, называют конформациями молекулы.
-связей, называют конформациями молекулы.
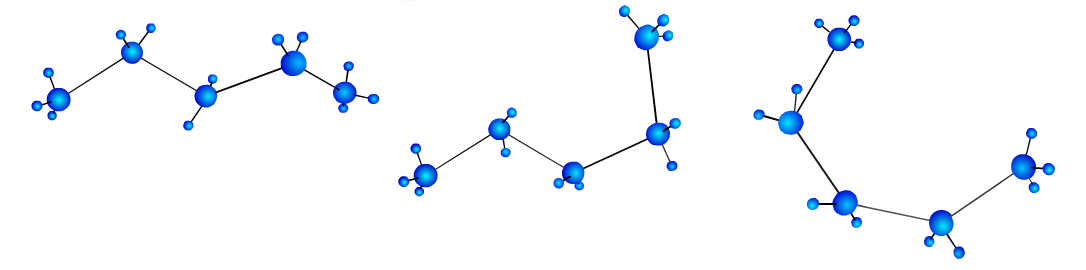
Номенклатура алканов
Первые четыре члена ряда алканов имеют исторически сложившиеся названия. Названия неразветвленных алканов с пятью и более атомами углерода в молекуле, образованы от греческих числительных, отражающих это число атомов углерода.
Суффикс -ан показывает принадлежность вещества к насыщенным соединениям.
Составляя названия разветвленных алканов по номенклатуре ИЮПАК, в качестве основной цепи выбирают цепь, содержащую максимальное число атомов углерода. Основную цепь нумеруют таким образом, чтобы заместители получили наименьшие номера. Если цепей одинаковой длины несколько, то главной выбирают цепь, содержащую наибольшее число заместителей.
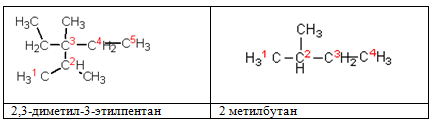
Физические свойства алканов
Температуры плавления и кипения в целом увеличиваются с увеличением числа атомов  в молекуле. Первые представители ряда алканов – газы при н.у., алканы, содержащие от 5 до 15 атомов
в молекуле. Первые представители ряда алканов – газы при н.у., алканы, содержащие от 5 до 15 атомов  – обычно жидкости, свыше 15 атомов
– обычно жидкости, свыше 15 атомов  – твердые вещества.
– твердые вещества.
Неразветвленные изомеры имеют более высокую температуру кипения, чем разветвленные (причина – разные силы межмолекулярного взаимодействия). Температуры плавления зависят, кроме того, от плотности упаковки молекул в кристалле.
Газообразные и твердые алканы не пахнут, жидкие алканы обладают характерным “бензиновым” запахом.
Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) сами широко используются как растворители.
Химические свойства алканов
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Одно из названий углеводородов этого ряда – парафины, обозначает их химическую пассивность. Поэтому химические свойства алканов определяются таким образом:
1. Из-за предельности алканов реакции присоединения для них нехарактерны.
2. Из-за прочных связей  и
и  (короткие и практически неполярные) следует малая реакционная способность (не реагируют с кислотами, щелочами,
(короткие и практически неполярные) следует малая реакционная способность (не реагируют с кислотами, щелочами,  и т.п.)
и т.п.)
3. Неполярность связей свидетельствует о том, что реакции могут проходить по свободнорадикальному механизму.
Основной тип реакций – радикальное замещение (radical substitution)  .
.
Разорвать связь можно при помощи нагревания или УФ-излучения. Обычно реакции алканов идут при повышенных температурах или на солнечном свету.
Реакция галогенирования.
При хлорировании атом  в молекуле метана замещается на атом
в молекуле метана замещается на атом  . В избытке хлора происходит дальнейшее замещение:
. В избытке хлора происходит дальнейшее замещение: ;
; ;
; ;
; .
.
Реакция нитрования.
По механизму радикального замещения протекает реакция нитрования алканов в газовой фазе (реакция Коновалова). Условия – повышенные температура и давление.
В парообразном состоянии азотная кислота разлагается: .
.
Оксид азота (IV) является радикалом  . Он атакует молекулу алкана.
. Он атакует молекулу алкана.
Итоговая реакция: .
.
Горение алканов
Смесь метана с кислородом (в объёмном соотношении 1:2) или с воздухом (1:10) при поджигании сгорает со взрывом. Поэтому смеси метана, пропана, этана, бутана с воздухом очень опасны. Они иногда могут образоваться в шахтах, в мастерских, в жилых помещениях. С этими газами нужно проявлять осторожность при применении.

Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии №31 "Теоретические основы органической химии (I)"
Онлайн-тест подготовки к ЗНО по химии №33 "Алканы"
Корисні посилання:
Класифікація органічних речовин












