Онлайн-урок №13 "Водень і сполуки Гідрогену"
Онлайн-урок №13 "Водень і сполуки Гідрогену"
25.12.2015 в 18.30
Конспекти до уроку:
Положение неметаллов в периодической системе Д. И. Менделеева
Неметаллы расположены в основном в правом верхнем углу в периодической системе Д.И. Менделеева, условно ограниченном диагональю бор-астат.
Особенности строения атомов неметаллов
Во внешнем электронном слое атомов неметаллов находится от трёх до восьми электронов.
До завершения внешнего электронного слоя им не хватает 1,2,3 электронов. Поэтому им выгоднее присоединять электроны, проявлять окислительные свойства. Наиболее они выражены у элементов VI и VII групп. Самый сильный окислитель – фтор. Окислительные свойства неметаллов возрастают в последовательности: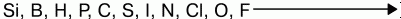
Фтор никогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов.
Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду: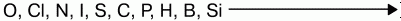
Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары.
Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
Неметаллы объединены в семейства, которые носят такие названия: пниктогены –V-А группа, халькогены – VI-А группа, галогены – VII-А группа, инертные газы – VIII-А группа.
Общие свойства неметаллов
У атомов элементов-неметаллов в периоде с увеличением порядкового номера
1. заряд ядра увеличивается;
2. радиусы атомов уменьшаются;
3. число электронов на внешнем слое увеличивается;
4. число валентных электронов увеличивается;
5. электроотрицательность увеличивается;
6. окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).
У атомов элементов-неметаллов в подгруппе (в длиннопериодной таблице – в группе) с увеличением порядкового номера
1. заряд ядра увеличивается;
2. радиус атома увеличивается;
3. электроотрицательность уменьшается;
4. число валентных электронов не изменяется;
5. число внешних электронов не изменяется (за исключением водорода и гелия);
6. окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).
Физические свойства неметаллов
Большинство неметаллов – простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет.
Молекулярные неметаллы:  (белый фосфор),
(белый фосфор),  .
.
К ним же можно отнести и благородные газы  , атомы которых являются как бы "одноатомными молекулами".
, атомы которых являются как бы "одноатомными молекулами".
При комнатной температуре водород, азот, кислород, озон, фтор и хлор – газы; бром – жидкость; фосфор, мышьяк, сера и йод – твердые вещества.
Немолекулярные неметаллы:  (несколько аллотропных модификаций),
(несколько аллотропных модификаций),  (графит),
(графит),  (алмаз),
(алмаз),  (красный),
(красный),  (черный),
(черный),  . Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами. Гораздо богаче у неметаллов, чем у металлов спектр цветов.
. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами. Гораздо богаче у неметаллов, чем у металлов спектр цветов.
Красный – у фосфора. Красно-бурый – у брома. Желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода.
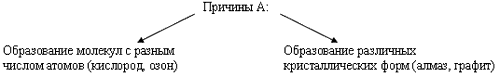
Аллотропия
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
Химические свойства неметаллов
Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера.
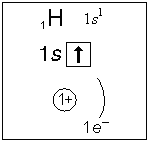
Электронное строение атома водорода
Ядро атома водорода имеет заряд (+1), то есть содержит только один протон, соответственно только один электрон на единственном энергетическом уровне. Схематично это представлено ниже, записывается с помощью электронной формулы следующим образом:
Физические свойства водорода 
Молекула  содержит неполярную σ-связь. Простое вещество водород
содержит неполярную σ-связь. Простое вещество водород  лёгкий бесцветный газ, без запаха и вкуса, устойчив к нагреванию до 2000 °С. Практически не растворяется в воде. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
лёгкий бесцветный газ, без запаха и вкуса, устойчив к нагреванию до 2000 °С. Практически не растворяется в воде. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
Физические константы: ,
, г/л (н.у.),
г/л (н.у.), пл
пл  ,
, кип
кип
Химические свойства
Водород  может проявлять в одних условиях восстановительные свойства (чаще), в других условиях – окислительные свойства (реже):
может проявлять в одних условиях восстановительные свойства (чаще), в других условиях – окислительные свойства (реже):
восстановитель 
окислитель 
При обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
и с единственным неметаллом – фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
Он может «отнимать» кислород от некоторых оксидов, например:
Записанное уравнение отражает восстановительные свойства водорода. →
→ 
С галогенами образует галогеноводороды: →
→  , реакция протекает со взрывом в темноте и при любой температуре,
, реакция протекает со взрывом в темноте и при любой температуре,
 →
→  , реакция протекает со взрывом, только на свету.
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании: →
→ 
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды: →
→ 
Качественная реакция на водород – сгорание с "хлопком" собранного в пробирку газа.
Распространённость
Водород – самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов. Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Три изотопа водорода имеют собственные названия: – протий (
– протий ( ),
),  – дейтерий (
– дейтерий ( ) и
) и  – тритий (радиоактивен) (
– тритий (радиоактивен) ( ).
).
Получение
Основной промышленный способ получения водорода – реакция с водой метана. ↑
↑ −165 кДж
−165 кДж
В лаборатории.
Действие разбавленных кислот на металлы.  →
→  ↑
↑
Применение
1. При производстве аммиака, метанола, мыла и пластмасс.
2. При производстве маргарина из жидких растительных масел.
3. Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ).
Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии №21 Неметаллические элементы
Онлайн-тест подготовки к ЗНО по химии №22 Водород и соединения Гидрогена
Корисні посилання:
Галилео. Эксперимент. Взрыв водорода












