Онлайн-урок №12 "Залізо та сполуки Феруму"
Онлайн-урок №12 "Железо и соединения Ферума"
18.12.2015 в 18.30
Конспекти до уроку:
Общие сведения
Железо (лат. Ferrum),  , химический элемент VIII группы периодической системы Менделеева. Порядковый номер 26, атомная масса 55,847. Блестящий серебристо-белый металл. Элемент в природе состоит из четырех стабильных изотопов:
, химический элемент VIII группы периодической системы Менделеева. Порядковый номер 26, атомная масса 55,847. Блестящий серебристо-белый металл. Элемент в природе состоит из четырех стабильных изотопов:  (5,84%),
(5,84%),  (91,68%),
(91,68%),  (2,17%) и
(2,17%) и  (0,31%).
(0,31%).
Историческая справка. Железо было известно еще в доисторические времена, однако широкое применение нашло значительно позже, так как в свободном состоянии встречается в природе крайне редко, а получение его из руд стало возможным лишь на определенном уровне развития техники. Вероятно, впервые человек познакомился с метеоритным Железом, о чем свидетельствуют его названия на языках древних народов: древнеегипетское "бени-пет" означает "небесное железо"; древнегреческое sideros связывают с латинским sidus (род. падеж sideris) – звезда, небесное тело. В хеттских текстах 14 века до н. э. упоминается о Железе как о металле, упавшем с неба. В романских языках сохранился корень названия, данного римлянами (например, франц. fer, итал. ferro).
Химические свойства железа и его соединений
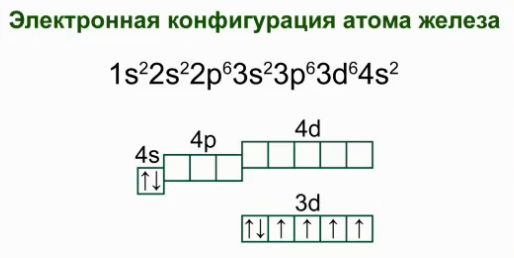
Железо – это химический элемент №26, который находится в побочной подгруппе VIII группы, в четвертом периоде. Электронная конфигурация атома железа  .
.
Степени окисления железа: 0,+2,+3.Соединения железа (III) проявляют слабые окислительные свойства, образуемые оксиды и гидроксиды  и
и  проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
1. Взаимодействие с неметаллами.
При нагревании железо особенно порошкообразное способно взаимодействовать практически со всеми неметаллами. Хлор и фтор окисляют железо до  , бром может окислить и до
, бром может окислить и до  и до
и до  в зависимости от количества, а йод окисляет только до степени окисления +2
в зависимости от количества, а йод окисляет только до степени окисления +2  . При реакции с серой сначала образуется сульфид железа, а затем дисульфид железа.
. При реакции с серой сначала образуется сульфид железа, а затем дисульфид железа. →
→ 
 →
→  природный минерал такого состава называется пирит.
природный минерал такого состава называется пирит.
Он используется для получения серной кислоты, а также железа и соединений железа.
2. Взаимодействие железа с кислородом.
При взаимодействии железа с кислородом в зависимости от его количества, могут образовываться разные оксиды. В том числе и смешанный оксид  .
. →
→ 
 →
→
 →
→ 
3. Взаимодействие железа с водой.
При сильном нагревании металлическое железо взаимодействует с водой. →
→ ↑
↑
Во влажном воздухе при обычных условиях железо реагирует с парами воды и кислородом, с образованием ржавчины. Она состоит из смешенных оксидов, гидроксидов и соединений кислорода. Это не индивидуальное вещество.
Примерная схема ржавления железа: →
→ 
4. Взаимодействие железа с кислотами.
Как и другие типичные металлы, железо взаимодействует с кислотами не окислителями с выделением водорода. →
→  ↑
↑
С кислотами окислителями железо не реагирует из-за пассивации. Но с разбавленными кислотами реакция происходит. →
→  ↑
↑ 
5. С растворами солей.
Металлическое железо вытесняет менее активные металлы из растворов их солей. →
→ 
Амфотерные свойства железа.
Железо и некоторые его соединения способны проявлять амфотерные свойства.
 →
→ ![Na_2[Fe(OH)_4] + H_2 Na_2[Fe(OH)_4] + H_2](/plugins/content/MathPublisher/mathpublisher/img/math_977.5_6519c893274deca8c141a9344f429898.png) ↑
↑
В горячем концентрированном растворе щелочи образуется комплексное соединение и выделяется водород.
Соединения железа(II)
Соли железа (II) можно получить при взаимодействии металлического железа с кислотами не окислителями или восстановлением железа(III).
 →
→ 
Соединения железа(II) обладают восстановительными свойствами. →
→  ↓
↓ .
.
На воздухе  ↓окисляется кислородом.
↓окисляется кислородом. ↓
↓ →
→  ↓
↓
Соединения железа(III)
Соли железа(III) получают либо окислением железа галогенами, либо при его взаимодействии с разбавленными кислотами окислителями. Соли железа(III) могут проявлять слабые окислительные свойства.
 →
→  ↓
↓  .
.
На этой реакции основан йодометрический способ определения солей железа.
Качественная реакция на соли железа(III)
 →
→![Na_3[Fe(SCN)_6] + 3NaCl Na_3[Fe(SCN)_6] + 3NaCl](/plugins/content/MathPublisher/mathpublisher/img/math_977.5_fba557eb28560195ef8d782e0898df5d.png) .
.
При взаимодействии с роданидами образуются ярко-красные похожие на кровь комплексы различного состава.
Взаимодействие со щелочью. →
→  ↓
↓
 ↓как и
↓как и  ↓ амфотерен, с преобладание основных свойств.
↓ амфотерен, с преобладание основных свойств. ↓
↓ →
→ 

 →
→ 
Железная кислота и её соли. При окислении  ↓ или при электролизе раствора щелочи на железном аноде образуются соли, содержащие железо в составе аниона:
↓ или при электролизе раствора щелочи на железном аноде образуются соли, содержащие железо в составе аниона: →
→
 →
→  ↑
↑
Железо имеет степень окисления +6 .Такие соли называются ферраты:  . Это соли несуществующей в свободном виде железной кислоты
. Это соли несуществующей в свободном виде железной кислоты  . Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
. Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
Значение переходных металлов для организма и жизнедеятельности
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит. 
При исследовании сплавов прослеживается уникальное значение железа для человека. Сплавы даже разделяют на черные и цветные по содержанию в них железа.
Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии №19 "Железо и соединения Ферума"
Онлайн-тест подготовки к ЗНО по химии №20 "Обобщение сведений о металлах и соединениях металлических элементов"
Корисні посилання:
Качественные реакции на ион двухвалентного железа
Качественная реакция на ион трехвалентного железа












