Онлайн-урок №10 "Лужні і лужноземельні метали"
Онлайн-урок №10 "Лужні і лужноземельні метали"
4.12.2015 в 18.30
Конспекти до уроку:
Физические свойства металлов
Металлами являются вещества, характеризующиеся в обычных условиях
1. высокими электро- и теплопроводностью,
2. ковкостью,
3. «металлическим» блеском,
4. непрозрачностью
Эти свойства обусловленными наличием в их кристаллической решетке большого количества не связанных с атомными ядрами подвижных электронов проводимости.
Свойства металлов объясняются особенностями их строения:
1. Расположением и характером движения электронов в атомах;
2. Расположением атомов, ионов и молекул в пространстве;
3. Размерами, формой и характером кристаллических образований.
Особенности атомного строения определяют характер взаимодействия металлов, способность их давать различного рода соединения, в которые входят несколько металлов, металлы с неметаллами и т. д.
При разных температурах некоторые химические элементы имеют 2 и более устойчивых типа кристаллических решеток.
Существование одного металла в различных кристаллических формах (модификациях) при разных температурах называется полиморфизмом, или аллотропией, а переход из одного строения в другое – полиморфным (аллотропическим) превращением.
Аллотропические формы, получающиеся в результате полиморфного превращения, обычно обозначают начальными буквами греческого алфавита α, β, γ, δ.
К таким полиморфным металлам относятся, например, кобальт (Со), олово (Sn), марганец (Мn), железо (Fe).
В свою очередь изменение строения кристаллической решетки вызывает изменение свойств – механических, химических и магнитных свойств, электропроводности, теплопроводности, теплоемкости и др. К металлам, которые имеют только один тип кристаллической решетки и называются изоморфными, относятся алюминий (А1), медь (Сu), никель (Ni), хром (Сr), ванадий (W) и др.
Металлы в природе
Металлы присутствуют в природе как в самородном состоянии (самородные металлы), так и в виде различных соединений.
В свободном состоянии присутствуют в природе металлы, которые либо плохо окисляются кислородом, либо совсем не окисляются. Например, платина, золото, серебро. Реже медь, ртуть и некоторые другие. Самородные металлы встречаются в природе в небольших количествах в виде зерен или вкраплении в различных минералах. Лишь изредка они образуют большие куски – самородки. Самый большой самородок золота весил 112 кг. Иногда металлы практически в чистом виде содержатся в метеоритах. Так некоторые предметы из высокочистого железа, найденные археологами, объясняются именно тем, что они были изготовлены из метеоритного железа.
Но чаще всего металлы существуют в природе в связанном состоянии в составе минералов.
Минерал – это химически и физически индивидуализированный продукт природной физико-химической реакции, находящийся в кристаллическом состоянии.
Очень часто это оксиды. Например, оксид железа(III)  – гематит или красный железняк.
– гематит или красный железняк.
 – магнетит или магнитный железняк. Нередко минералами являются сульфидные соединения: галенит ZnS, киноварь HgS.
– магнетит или магнитный железняк. Нередко минералами являются сульфидные соединения: галенит ZnS, киноварь HgS.
Активные металлы часто присутствуют в природе в виде солей (сульфаты, нитраты, хлориды, карбонаты).
Получение металлов
Минералы входят в состав горных пород и руд.
Рудами называются природные образования, содержащие минералы в таком количестве, чтоб из этих руд было выгодно получать металлы. Обычно перед получением металла из руды, руду обогащают, удаляя пустую породу и различные примеси. При этом образуется концентрат, который и является исходным сырьем для металлургической промышленности.
Существуют различные способы обогащения руды. Один из них флотация.
Для получения металлов из руд необходимо перевести металлы из руд в какую-нибудь единую форму, чаще всего в форму оксидов.


Полученные оксиды можно восстанавливать несколькими способами.
1. Один из основных – это металлотермия.
А. Алюмотермия (алюминотермия)

Б. Магниетермия.

Можно проводить восстановление и другими веществами. ↑
↑
2. Термическое разложение соединений металлов. ↑
↑ ↑
↑
Этот метод применяется для получения высокочистых металлов.
3. Электролитическое получение металлов.
Металлы, особенно, активные можно получить при электролизе расплавов электролитов. Для щелочных металлов – это единственный способ их получения. Возможно получение металлов при электролизе водных растворов солей. Катионы металлов, расположенных в электрохимическом ряду напряжений до водорода, разряжаются на катоде в той или иной степени одновременно с молекулами воды. А в случае солей металлов, расположенных правее водорода, на катоде получается только соответствующий металл.
4. Более активный металл вытесняет менее активный из раствора его соли.
В таких реакциях нельзя использовать щелочные и щелочноземельные металлы, потому что они реагируют с водой.
Коррозия металлов
Коррозия – самопроизвольное разрушение металлов и сплавов под воздействием окружающей среды. Коррозию металлов и сплавов вызывают такие компоненты окружающей среды как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, морская вода и грунтовые воды.
По типу агрессивных сред, в которых протекает коррозия, она может быть следующих видов: 
2. Атмосферная коррозия
3. Коррозия в не электролитах
4. Коррозия в электролитах
5. Подземная коррозия
6. Биокоррозия
Чаще всего коррозии подвергаются изделия из железа.
Особенно сильно коррозируют металлы во влажном воздухе и в воде. В повседневной жизни для сплавов железа чаще всего использую термин «ржавление». Химически чистое железо ржавеет медленно, техническое железо, содержащее различные примеси ржавеет быстро. Коррозия зависит не только от химического состава объекта, но и от того какие примеси и в каком количестве этот объект содержит.
Способы борьбы с коррозией.
1. Нанесение различных покрытий на поверхность металла (краски, эмали, другой металл).
2. Использование нержавеющих сплавов, добавки к железу Cr, Ni, Ti.
3. Введение ингибиторов коррозии.
4. Контакт с более активным металлом, протектором. Сначала будет корродировать протектор, потом защищаемый металл.
Физические свойства щелочных металлов
Главную подгруппу I группы Периодической системы Д. И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
1.Цвет. Щелочные металлы, кроме Cs, имеют серебристый металлический блеск,
Cs – золотисто-желтую окраску.
2.Твердость. Все щелочные металлы очень мягки, легко режутся (кроме Li), Rb, Cs и Fr при обычной температуре почти пастообразны, наиболее твердый из них Li мягче талька (твердость талька принята за единицу по шкале Мооса).
3.Температура плавления. Щелочные металлы кристаллизуются в кубичической объемноцентрированной решетке. Температуры плавления их уменьшаются от Li к Cs: 180,54 °С (Li), 97,86 °С (Na), 63,51 °С (К), 39,32 °С (Rb), 28,44 °С (Cs).
4.Плотность. Щелочные металлы очень легкие, самый легкий среди всех известных металлов – Li, он плавает в керосине, a Na и К легче воды.
5.Активность. Сильно электроположительный характер и высокая химическая активность щелочных металлов обусловлены небольшой затратой энергии на отрыв от атомов этих металлов одного s-электрона. Щелочные металлы – сильные восстановители.
Электронное строение
Электронные конфигурации валентного слоя щелочных металлов  , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов
, где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов  (s-элементы). У алюминия валентные электроны
(s-элементы). У алюминия валентные электроны  (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
(p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях

Ионы металлов легко определить по изменению окраски пламени.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Соли щелочноземельных металлов: кальция-кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами.
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом, с образованием сульфидов, гидридов, фосфидов.
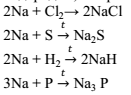
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре. , образующийся нитрид лития подвергается необратимому гидролизу.
, образующийся нитрид лития подвергается необратимому гидролизу. ↑
↑
2. Взаимодействие с кислородом.
Только с литием сразу образуется оксид лития. , а при взаимодействии кислорода с натрием, образуется пероксид натрия.
, а при взаимодействии кислорода с натрием, образуется пероксид натрия. . При горении всех остальных металлов, образуются надпероксиды.
. При горении всех остальных металлов, образуются надпероксиды.
3. Взаимодействие с водой.
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий со вспышкой, а цезий уже с взрывом.  ↑
↑
4. Взаимодействие с кислотами – сильными окислителями. (конц) →
(конц) → 
 (конц) →
(конц) →  ↑ +
↑ + 
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Применение щелочных металлов
Соединения щелочных металлов находят большое применение в разных отраслях промышленности.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
|
Едкий натр (каустическая сода) |
|
|
Чилийская селитра |
|
|
Глауберова соль |
|
|
Сода кристаллическая |
|
|
Едкое кали |
|
|
Хлорид калия (сильвин) |
|
|
Индийская селитра |
|
|
Поташ |
Физические свойства щелочноземельных металлов
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И.Менделеева. Это магний  , кальций
, кальций  , стронций
, стронций  , барий
, барий  и радий
и радий  .
.
Практически все эти элементы представляют собой твердые вещества сероватого цвета (по крайне мере, при нормальных условиях и комнатной температуре). Кстати, физические свойства щелочных металлов немного отличаются – эти вещества хотя и довольно стойкие, но легко поддаются воздействию. Интересно, что с порядковым номером в таблице растет и такой показатель металла, как плотность. Например, в этой группе наименьшим показателем обладает кальций, в то время как радий по плотности сходен с железом.
Химические свойства щелочноземельных металлов
Обнаружение ионов металла в солях.
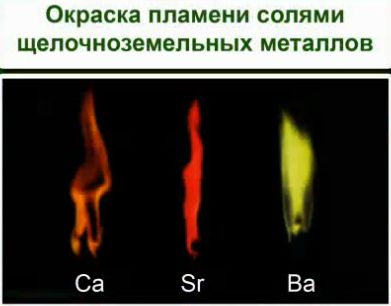
Ионы металлов легко определить по изменению окраски пламени.
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато- зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Металлы - восстановители.
Щелочные и щелочноземельные металлы, как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария  – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
– бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
1. С неметаллами. →
→ 
 →
→
 →
→ 
 →
→
2. Взаимодействие с кислородом. →
→ 
3. Взаимодействие с водой. →
→  ↑, но взаимодействие более спокойное, чем с щелочными металлами.
↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями. (конц) →
(конц) → 
 (конц) →
(конц) →  ↑
↑ 
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов. →
→ 
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария. →
→ 
Применение щелочноземельных металлов
Самыми известными соединениями щелочноземельным металлов являются:  – негашеная известь.
– негашеная известь.  – гашеная известь или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция
– гашеная известь или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция  .Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
.Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает. →
→ 
 ↑ →
↑ →  ↓
↓
 ↓
↓ →
→ 
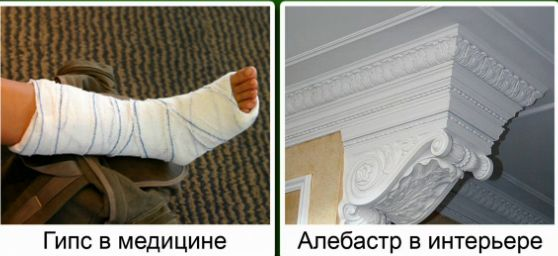
Гипс – это  , алебастр –
, алебастр –  . Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий.
. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. 
Карбонат кальция  образует множество различных минералов.
образует множество различных минералов.
Фосфат кальция  - фосфорит, фосфорная мука используется как минеральное удобрение.
- фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция  – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
– это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция  . Его можно получить
. Его можно получить  →
→ . Одно из его применений – это получение ацетилена.
. Одно из его применений – это получение ацетилена. →
→ ↑
↑
Сульфат бария  – барит. Используется как эталон белого в некоторых исследованиях.
– барит. Используется как эталон белого в некоторых исследованиях.
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния  и
и  . Такую жесткость воды можно устранить кипячением.
. Такую жесткость воды можно устранить кипячением. →
→ ↓
↓  ↑
↑ 
Постоянная жесткость воды обусловлена наличием катионов  ,
,  и анионов
и анионов  и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок. →
→  ↓
↓ 
Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии №16 "Общие сведения о металлических элементах и металлах"
Онлайн-тест подготовки к ЗНО по химии №17 "Щелочные и щелочноземельные металлы"
Корисні посилання:
Взаимодействие щелочных металлов с водой
Самые опасные щелочные металлы в мире





















