Онлайн-урок №8 "Кислоти. Солі"
Онлайн-урок №8 "Кислоти. Солі"
20.11.2015 о 18.30
Конспекти до уроку:
Общая характеристика кислот
Кислота – это сложное вещество, содержащие один или несколько атомов водорода, способных при химических реакциях замещаться на атомы металла и кислотного остатка.
Кислотным остатком называют часть молекулы кислоты, соединенную с атомом водорода
При замещении водорода в кислотах металлами, кислотные остатки переходят в неизменном виде в состав образующихся веществ – солей. Если кислотный остаток в кислоте соединен с одним атомом водорода, то он одновалентен, если с двумя - двухвалентен, если с тремя – трехвалентен и т.д.
Валентность кислотного остатка определяется количеством атомов водорода в кислоте.
Формулы и названия важнейших кислот указаны в таблице.
Важнейшие неорганические кислоты.
| Название кислоты | Формула кислоты | Кислотный остаток | Название солей |
| Фтороводородная (плавиковая) |  |
 |
Фторид |
| Хлороводородная (соляная) |  |
 |
Хлорид |
| Бромоводородная |  |
 |
Бромид |
| Угольная |  |
= |
Карбонат |
| Кремниевая |  |
=  |
Силикат |
| Азотная |  |
 |
Нитрат |
| Ортофосфорная |  |
 |
Ортофосфат |
| Серная |
|
= |
Сульфат |
| Сернистая |  |
=  |
Сульфит |
| Сероводородная |  |
=  |
Сульфид |
Одним из представителей органических кислот является уксусная кислота  .
.
Кислоты в природе
Слово «кислота» по значению связано со словом «кислый», так как имеют общий корень. Отсюда следует, что растворы всех кислот имеют кислый вкус.
Несмотря на это, не следует пробовать на вкус никакие растворы кислот, так как некоторые из них относятся к едким и ядовитым растворам.
Природные источники кислот.

В природе встречается много кислот: лимонная кислота в лимонах, яблочная кислота – в яблоках, щавелевая кислота – в листьях щавеля.
Муравьи защищаются от врагов, выбрасывая едкие капельки муравьиной кислоты. (Она же содержится в пчелином яде и жгучих волосках крапивы.)
При прокисании виноградного сока получается всем известная уксусная кислота (уксус), а при прокисании молока – молочная кислота, та же самая молочная кислота получается при квашении капусты.
Классификация кислот
Кислоты делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
1. Существуют бескислородные и кислородсодержащие кислоты. Название этих групп указывает на наличие или отсутствие в молекуле кислоты атомов кислорода.
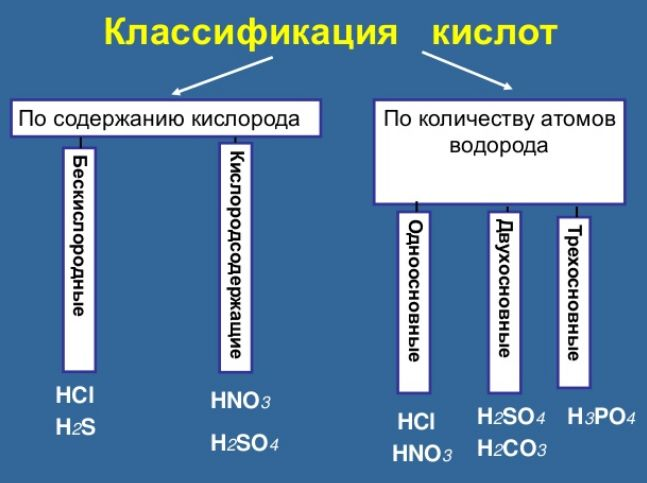
2. Другой признак классификации кислот – количество атомов водорода в кислоте. Соответствующую характеристику кислоты называют основностью. Существуют одно-, двух-, трехосновные кислоты.
3. Приведем еще один признак классификации кислот, как электролитов по степени электролитической диссоциации. Кислота – это электролит, водный раствор которого содержит катионы водорода и анионы кислотного остатка. Если электролит диссоциирует практически нацело – это сильный электролит. Электролит, степень диссоциации которого мала, это слабый электролит.
Классификация по степени электролитической диссоциации.
| Признак классификации | ||
| Степень электролитической диссоциации | Сильные кислоты |  |
| Слабые кислоты |  |
|
Физические свойства кислот
Агрегатное состояние.
При обычных условиях кислоты могут быть твердыми веществами(ортофосфорная  , кремниевая
, кремниевая  ) и жидкостями (в чистом виде жидкостью будет серная кислота
) и жидкостями (в чистом виде жидкостью будет серная кислота  ).
).
Такие газы как хлороводород  , бромоводород
, бромоводород  , сероводород
, сероводород  , в водных растворах образуют соответствующие кислоты.
, в водных растворах образуют соответствующие кислоты.
Цвет.
Водные растворы соляной, азотной, серной, ортофосфорной и ряда других кислот не имеют окраски. Водные растворы хромовой кислоты  имеют желтую окраску, марганцевой кислоты
имеют желтую окраску, марганцевой кислоты  – малиновую.
– малиновую.
Запах.
Некоторые кислоты имеют запах. Например, кислоты:  .
.
Растворением в воде сероводорода получают сероводородную кислоту  .Тухлые яйца пахнут сероводородом. К особым свойствам этой кислоты относится то, что она не очень едкая и очень ядовита.
.Тухлые яйца пахнут сероводородом. К особым свойствам этой кислоты относится то, что она не очень едкая и очень ядовита.
Растворимость, летучесть и стабильность некоторых кислот.
| Физические свойства | Группы кислот | Пример |
| Растворимость | Растворимые |  |
| Нерастворимые |  |
|
| Летучесть | Летучие |  |
| Нелетучие |  |
|
| Стабильность | Стабильные |  |
| Нестабильные |  |
Меры предосторожности
Серная, соляная, уксусная кислоты могут вызывать сильные ожоги, разрушать ткани. Поэтому при работе с кислотами необходимо соблюдать меры предосторожности.
Если кислота попала на одежду или на поверхность тела, то её необходимо очень быстро смыть большим количеством проточной воды или нейтрализовать нашатырным спиртом.
Если кислота попала на деревянную, металлическую или на другие поверхности, то ее нейтрализуют известью, мелом или содой. Кислоты необходимо хранить в хорошо укупоренной посуде в недоступном месте для детей, и обязательно на таре должна быть бирка с названием кислоты.
Серная кислота является более сильной кислотой, чем соляная. Концентрированная серная кислота обугливает сахар, дерево, хлопок, шерсть и вызывает очень глубокие ожоги кожи.
При приготовлении раствора серной кислоты необходимо следовать следующему правилу: Кислоту льют в воду тонкой струйкой по стенке стеклянной посуды, но не наоборот.

Химические свойства кислот
1. Действие на индикаторы.
Кислоты в водных растворах изменяют окраску индикаторов.
В кислой среде фиолетовый лакмус приобретает красную окраску. Метиловый оранжевый – красную, а фенолфталеиновый – бесцветный. Если в раствор кислоты добавим по несколько капель универсального индикатора, он также поменяет окраску на красную.
Окраска индикаторов в различных средах. 
2. Реакция с металлами.
Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов до водорода. При этом получается соль и выделяется водород.
Металлы, расположенные в ряду активности металлов до водорода, вытесняют водород из кислот. Каждый предыдущий металл активнее, чем каждый последующий. ↑
↑
Эта реакция относится к реакциям замещения.
Реакцию между простым и сложным веществами, в результате которой образуются новые простое и сложное вещества, называют реакцией замещения.
При реакциях азотной кислоты и концентрированной серной кислоты с металлами образуются соли, но водород не выделяется.
3. Реакция с основными и амфотерными оксидами с образованием соли и воды.

Произошла реакция обмена: два сложных вещества обменялись своими составными частями.
4. Реагируют с основаниями.


Реакция нейтрализации – реакция между кислотой и основанием, в результате которой получается соль и вода.
5.Реакция с солями.
Реакции кислот с солями не всегда возможны.
А. Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок. ↓
↓ 
 ↓
↓ 
Б. Если кислота – продукт является летучей, происходит от газообразного соединения или разлагается с образованием газа. (тв.)
(тв.)  (конц.)
(конц.)  ↑
↑
Сокращение (тв.) означает «твердое вещество», а (конц.) – «концентрированный раствор».
В. Если кислота, которая вступает в реакцию, является сильной, а кислота, которая образуется, – слабой.
Пользуясь вытеснительным рядом кислот можно предсказать течение реакции. Каждая предыдущая кислота может вытеснить из соли последующую.
Например,
 ↑,
↑,
но не будет происходить реакция между  , потому что в
, потому что в  слабее
слабее  и не вытеснит её из соли этой кислоты.
и не вытеснит её из соли этой кислоты.
Вытеснительный ряд кислот.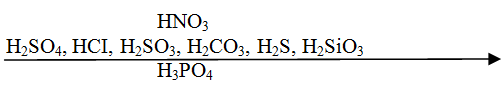
Взаимодействие кислот с солями также относится к реакциям обмена.
6. Термическое разложение кислородсодержащих кислот.
Кислородсодержащие кислоты при нагревании, а угольная кислота и сернистая в обычных условиях, разлагаются с образованием соответствующих кислотных оксидов и воды: 
Химические свойства кислот можно обобщить таким образом:
А. Изменяют цвет индикаторов
Б. Реагируют с металлами
В. Реагируют с основными и амфотерными оксидами
Г. Реагируют с основаниями
Д. Реагируют с солями (более слабых и летучих кислот)
Е. Некоторые кислоты разлагаются при нагревании.
Применение кислот
В промышленности.
Наибольшее применение получили серная, соляная, азотная и ортофосфорная кислоты. Их получают на химических заводах в больших количествах.
| Кислота | Область применения |
 |
Производство других кислот, солей, удобрений, красителей, лекарств, очистка нефтепродуктов. Серную кислоту, за счет ее свойств поглощать большие количества воды, используют для осушения. Применяется для приготовления аккумуляторной кислоты. |
 |
Производство солей, красок, лекарств. |
 |
Производство удобрений, красителей, взрывчатых веществ. |
 |
Производство удобрений, моющих средств. |
В медицине.
Борная кислота - находит применение в медицине (борная мазь).
Ортофосфорная кислота широко применяется в стоматологии при пломбировании зубов. Ею протравливают зубную эмаль перед процедурой. Также в незначительных количествах ортофосфорная кислота применяется в составах отбеливателей для зубов.
Раствор соляной (хлороводородной) кислоты применяется для лечения заболеваний желудочно-кишечного тракта (гастрит, панкреатит).
В быту.
Лимонная кислота используется для выведения всевозможных пятен: от вина, различных ягод, красок, ржавчины, чернил.
Щавелевая кислота применяется для удаления пятен от чернил, краски, ржавчины. Кристаллическая кислота может вызвать ожоги слизистых оболочек ротовой полости, пищевода и желудка. Является ядовитым веществом.
Борная кислота – в качестве микроудобрения и средства для борьбы с тараканами и домовыми муравьями.
Уксусная кислота применяется либо в виде столового уксуса, с концентрацией кислоты до 9% или в виде 80 %-ной эссенции. Разбавленная кислота не действует на металлы, ткани растительного и животного происхождения, покровы человека и животных. Уксус применяется в качестве приправы к блюдам, удаления фруктовых пятен с тканей.
Соляная кислота хорошо растворяет металлы, в том числе цинк, олово, железо, но не взаимодействует с золотом, серебром и медью. Применяется для очистки от известкового налета раковины эмалированные и фаянсовые, унитазы, умывальники. Можно применять для очистки тканей от ржавых пятен, чернил (готовится слабый раствор кислоты). Соляная кислота разрушает ткани, изготовленные из льна, хлопка, искусственного шелка. При попадании на кожу вызывает химические ожоги.
Азотная кислота в быту используется только в виде разбавленных растворов для чистки изделий, в первую очередь из благородных металлов.
Общие способы получения кислот
1. Бескислородные кислоты получают при растворении в воде газообразных соединений неметаллов с водородом. Так, например, соляная кислота получается в результате растворения газа хлороводорода  в воде, сероводородная кислота получается в результате растворения газа сероводорода
в воде, сероводородная кислота получается в результате растворения газа сероводорода  в воде.
в воде.

2. Кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой.

3. Получение кислот вытеснением из солей слабых кислот сильными, летучих нелетучими, растворимых – нерастворимыми. Например, сильная соляная кислота вытесняет слабую уксусную из растворов их солей.
 (тв.)
(тв.)  ↑
↑
Конспект 11. Соли
Соли – это электролиты, в результате диссоциации их водных растворов образуются катионы металлов и анионы кислотных остатков.
Классификация солей
Соли бывают:
1. Средние
2. Кислые
3. Основные
4. Двойные
5. Смешанные
6. Комплексные
Средние соли
В состав солей входят катионы металлов  и кислотные остатки. Если кислотный остаток не содержит водорода, соли называют средними
и кислотные остатки. Если кислотный остаток не содержит водорода, соли называют средними  – сульфат кальция
– сульфат кальция – нитрат свинца(II)
– нитрат свинца(II) – ортофосфат кальция
– ортофосфат кальция – карбонат меди(II)
– карбонат меди(II) – нитрат лантана(III)
– нитрат лантана(III)
Средние соли – продукты полной нейтрализации кислот основаниями: ↓
↓  .
.
Кислые соли – продукты неполной нейтрализации:
Соли, содержащие кислотные остатки с незамещенными атомами водорода, называются кислыми, например: – гидросульф т кальция
– гидросульф т кальция – гидрокарбонат железа(II)
– гидрокарбонат железа(II) – дигидроортофосфат бария
– дигидроортофосфат бария – гидроортофосфат бария
– гидроортофосфат бария
Основные соли.
Соли, содержащие в своем составе гидроксогруппы, называются оснóвными, например: – дигидроксид-сульфат кальция
– дигидроксид-сульфат кальция – дигидроксид-карбонат димеди
– дигидроксид-карбонат димеди
Оснóвные соли – продукты неполной нейтрализации:
Возможна и дальнейшая нейтрализация основных солей избытком кислотного гидроксида
Двойные и смешанные соли
Известны также соли, содержащие два химически разных катиона – двойные соли или аниона – смешанные соли. Примеры: – сульфат алюминия-калия
– сульфат алюминия-калия  – сульфат диаммония-железа(II)
– сульфат диаммония-железа(II) – метасиликат алюминия-лития
– метасиликат алюминия-лития – хлорид-гипохлорит кальция
– хлорид-гипохлорит кальция – гидрокарбонат-карбонат натрия
– гидрокарбонат-карбонат натрия – нитрат-иодат натрия
– нитрат-иодат натрия
Часто двойные и смешанные соли малорастворимы в воде. Многие двойные и смешанные соли могут быть получены путем совместной кристаллизации при охлаждении из растворе смеси солей. Например:
Соли в природе
Очень многие соли, используемые химиками, встречаются в природе.
Природные соли можно классифицировать следующим образом.
Минеральные соли.
| Бинарные соединения | Сульфиды, галогениды |
| Соли с анионом, содержащим неметалл (металлоид) | Карбонаты, сульфаты, фосфаты, нитраты, бораты, арсенаты, силикаты, алюмосиликаты. |
| Соли с анионом, содержащим металл |
Хроматы, вольфраматы, молибдаты, ванадаты. |
Физические свойства

В обычных условиях все соли – это твердые бесцветные вещества. Но некоторые ионы придают им окраску. Например, соли двухвалентной меди, трехвалентного хрома и никеля окрашены в зеленый цвет Перманганаты – фиолетовые. Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые.
Растворимость солей может быть различной. Хорошо растворимы нитраты, почти все соли щелочных металлов и аммония.
Химические свойства солей
1. Взаимодействие с металлами.
Более активные восстановители вытесняют менее активные из раствора их солей. Активность метала можно определить в электрохимическом ряду напряжения металлов.

Однако щелочные и щелочноземельные металлы реагируют с растворами солей иначе.
Эти металлы сначала реагируют с водой. При этом образуется щелочь и выделяется водород. ↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид.
↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид. ↓
↓
2. Реагируют со щелочами.
 ↓
↓ 
3. Реакция с кислотами (если образуется осадок или газ)
 ↓
↓ (качественная реакция на галогеноводородные кислоты.)
(качественная реакция на галогеноводородные кислоты.) ↓
↓ (качественная реакция на серную кислоту и её соли.)
(качественная реакция на серную кислоту и её соли.)
 ↑ (качественная реакция на карбонаты)
↑ (качественная реакция на карбонаты)
4. Реагируют с кислотами (с более сильными или менее летучими).

 (тв.)
(тв.) (конц.)
(конц.)  ↑
↑ (тв.)
(тв.)  (конц.)
(конц.) 
 ↑
↑
5. Реагируют с солями.
 ↓
↓ 
6. Разложение при нагревании.


7. Гидролиз
Некоторые соли способны подвергаться необратимому гидролизу в водных растворах.
2Al(NO3)3 +3 Na2S + 6H2O = 2Al(OH)3↓ +3H2S↑ + 6NaNO3
Химические свойства кислых солей
Кислые соли, как правило, растворимы в воде лучше, чем средние соли. Например, гидрокарбонат кальция растворим в воде, а карбонат кальция – нет. Дигидропроизводные кислот растворимы в воде лучше гидропроизводных соответствующих кислот.
1. Разлагаются при нагревании.
Ca(НCO 3)2 CaСO3↓ + CO2 ↑+ Н2О
2. Взаимодействую с основаниями с получением средних солей.
Ca(НCO 3)2 +Сa(OH)2 = 2CaСO3↓ + 2Н2О
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
3. Кислые соли вступают в такие же реакции, как и средние. Обменные реакции друг с другом. ↓
↓ 
Получение средних солей
1. Взаимодействие гидроксидов с кислотами.
2. Реакция кислотных оксидов со щелочами.

3. Реакция основного оксида с кислотой.

4. Реакция металла и неметалла (соли бескислородных кислот)
Методы получения кислых солей
1. Неполная нейтрализация многоосновных кислот.

2. Взаимодействие средних солей с оксидами. ↓
↓ 
Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии №12 "Кислоты"
Онлайн-тест подготовки к ЗНО по химии №13 "Классы неорганических соединений. Соли"
Корисні посилання:
Некоторые химические свойства солей












