Онлайн-урок №5 "Хімічний зв’язок"
Онлайн-урок "Хімічний зв’язок"
30.10.2015 о 18.30
Конспекти до уроку:
Природа химической связи
Способы образования химической связи различны, поэтому и выделяют несколько типов химической связи:
1. Ковалентная
2. Водородная
3. Металлическая
4. Ионная.
Каждый химический элемент обладает своей способностью притягивать к себе внешние, чужие электроны.
Электроотрицательность
Способность атома притягивать к себе электроны называется электроотрицательностью.
Электроотрицательность нельзя выразить в единицах любых физических величин. Поэтому было разработано несколько шкал относительной электроотрицательности.
Шкала электроотрицательности.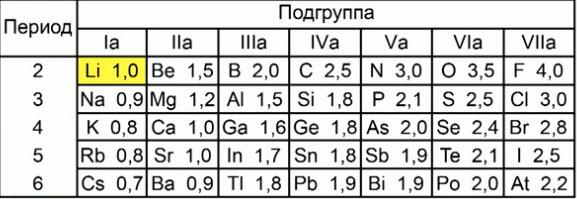
Наибольшее признание получила шкала электроотрицательности, разработанная Л.К. Полингом.
Чем меньше электронов требуется атому для завершения внешнего электронного уровня, тем большим значением электроотрицательности он обладает.
Например, если сравнить хлор и серу, то большим значением электроотрицательности будет обладать хлор. Ему до достижения октета электронов требуется всего 1 электрон, а атому серы – 2.
Электронная конфигурация внешнего слоя

В периоде электроотрицательность будет возрастать слева направо.
Если же рассматривать элементы одной группы, которые имеют на внешнем слое одинаковое количество электронов, то большим значением электроотрицательности будет обладать тот элемент, у которого меньше радиус. Т.е. тот, который находится выше по группе.
Сравнивая фтор и хлор можно с уверенностью сказать, что фтор  обладает большей электроотрицательностью, чем хлор
обладает большей электроотрицательностью, чем хлор  .
.
Фтор самый электроотрицательный элемент. Наименьшим значением электроотрицательности обладают щелочные металлы.
Ионная связь
Ионная связь – это связь между атомами резко отличающими по электроотрицательности: у одного она очень высокая, у другого – низкая.
В этом случае, атом с меньшей электроотрицательностью полностью отдает свои валентные электроны атому с большей электроотрицательностью.
Ионная связь образуется между металлами и неметаллами.
Такой тип связи в  и др. При образовании ионной связи образуются заряженные частицы: ионы.
и др. При образовании ионной связи образуются заряженные частицы: ионы.
Катионы – положительно заряженные ионы. Их образуют атомы, в которых мало валентных электронов и они слабо связаны с ядром. Это атомы щелочных и щелочноземельных металлов.
Анионы – отрицательно заряженные ионы. Их легче всего образуют галогены. Элементы главной подгруппы 7 группы. До завершения валентного уровня им не хватает всего одного электрона.
Схема образования ионной связи на примере хлорида натрия.

Атом натрия, имеет на внешнем уровне всего один электрон. Он легко отдает его, превращаясь в катион натрия  . Атому хлора до октета электронов не хватает одного электрона. Он его забирает у атома натрия, превращаясь в анион хлора
. Атому хлора до октета электронов не хватает одного электрона. Он его забирает у атома натрия, превращаясь в анион хлора 
Ионная связь возникает за счет сил электростатического притяжения разноименно заряженных ионов.
Ковалентная связь
Ковалентная неполярная связь.
Образование связи между двумя атомами водорода в молекуле водорода  .
.
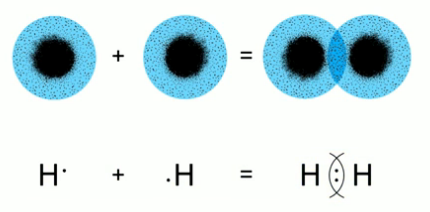
Химическая связь образуется в результате перекрывания атомных орбиталей. В этом случае между ядрами двух атомов образуется область повышенной электронной плотности. Такое состояние энергетически выгодно для обоих атомов, так как в данном случае оба электрона в равной степени принадлежат обоим атомам. Образование связи в молекуле водорода можно показать как с помощью перекрывания атомных орбиталей, так и с помощью формул Льюиса. Два электрона стали общими для обоих атомов водорода. Так как в атоме водорода всего один электронный слой, и он завершен, если на нем два электрона, такое состояние выгодно для обоих атомов – образовалась химическая связь.
Химическая связь, образующаяся в результате перекрывания атомных орбиталей, при котором пара электронов становится общей для обоих атомов, называется ковалентной связью.
Обратите внимание: при ковалентной связи пара электронов становится общей для обоих атомов. Образование молекулы водорода – это пример ковалентной связи. При этом область повышенной электронной плотности находится посередине относительно центров ядер атомов, то есть пара электронов в равной степени принадлежит обоим атомам водорода. Такая связь называется ковалентной неполярной связью.
Химическую связь между атомами элементов, в результате которой электроны в равной степени принадлежат обоим атомам, называют ковалентной неполярной связью.
Ковалентная полярная связь.
Ковалентная полярная связь в молекуле хлороводорода.
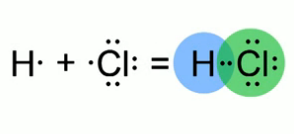
Зная, что ковалентная связь образуется за счет общих электронных пар, изобразим модель молекулы хлороводорода. Атом водорода имеет на внешнем электронном слое всего один электрон. Атом хлора – семь электронов. Эти атомы приобретут энергетически выгодное состояние, если атому водорода будет принадлежать два электрона, а атому хлора – восемь. Такое возможно при образовании одной общей электронной пары. Связь, образующаяся между водородом и хлором, в молекуле хлороводорода отличается от той химической связи, которая реализуется в молекулах простых веществ водорода и хлора. Это подтверждают экспериментальные данные. Например: атом водорода в молекуле  , может замещаться на атомы металла, а раствор хлороводорода в воде проводит электрический ток. Общая электронная пара между двумя атомами не находится в равноудаленном от них положении. Например, в молекуле хлороводорода электронная плотность на атоме хлора (это элемент с более высокой электроотрицательностью) выше, чем у атома водорода. В молекуле хлороводорода химическая связь – полярная.
, может замещаться на атомы металла, а раствор хлороводорода в воде проводит электрический ток. Общая электронная пара между двумя атомами не находится в равноудаленном от них положении. Например, в молекуле хлороводорода электронная плотность на атоме хлора (это элемент с более высокой электроотрицательностью) выше, чем у атома водорода. В молекуле хлороводорода химическая связь – полярная.
Металлическая связь
Металлическая связь - это тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Металлическая связь.
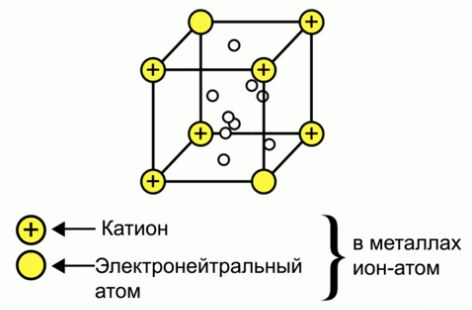
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства – узлах кристаллической решётки.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
Водородная связь
При изучении многих веществ были обнаружены так называемые водородные связи.
Водородная связь образуется между сильно поляризованным, обладающим значительной долей положительного заряда атомом водорода и другим атомом с очень высокой электроотрицательностью: фтором, кислородом или азотом.
Например, молекулы  в жидком фтороводороде связаны между собой водородной связью.
в жидком фтороводороде связаны между собой водородной связью.
Аналогично связаны молекулы  в жидкой воде или в кристалле льда.
в жидкой воде или в кристалле льда.
Водородная связь в молекуле воды.
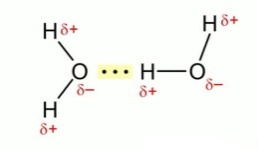
Молекулы  и
и  между собой в межмолекулярном соединении – гидрате аммиака
между собой в межмолекулярном соединении – гидрате аммиака  связаны водородной связью.
связаны водородной связью.
Водородные связи малоустойчивы и разрушаются довольно легко (например, при плавлении льда, кипении воды). Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления и кипения веществ с водородными связями между молекулами оказываются значительно выше, чем у подобных веществ, но без них.
Тести до уроку:
Online-тест подготовки к ЗНО по химии №6 "Химические связи"
Корисні посилання:












