Онлайн-урок №12 "Основы термодинамики. Законы термодинамики. КПД тепловой машины."
Онлайн-урок №12 "Основы термодинамики. Законы термодинамики. КПД тепловой машины."
15.12.2015 о 18.30
Конспекты к уроку:
1. Введение в термодинамику газов
Основные термодинамические параметры:
1) Работа газа
Работа для изобарного процесса, Дж: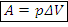
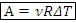
Замечание. Газ совершает работу только при изменении объема.
Знаки работы газа:
А>0 – расширение газа (работа газа)
А<0 – сжатие газа (работа над газом)
Замечание. А=0 для изохорного процесса.
2) Определение. Внутренняя энергия 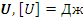 – сумма кинетической энергии теплового движения и потенциальной энергии взаимодействия всех частиц тела.
– сумма кинетической энергии теплового движения и потенциальной энергии взаимодействия всех частиц тела.
Внутренняя энергия, Дж:
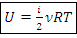
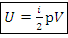
Где i – степень свободы движения частицы газа:
i=3 для одноатомного газа:  …
…
i=5 двухатомного газа:  …
…
i=6 многоатомного газа:  …
…
Изменение внутренней энергии, Дж: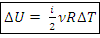
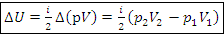
Изменение внутренней энергии в изопроцессах через параметры p-V, Дж: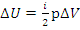 – изобарный процесс
– изобарный процесс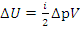 – изохорный процесс
– изохорный процесс 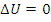 – изотермический процесс
– изотермический процесс
3) Определение. Количество теплоты 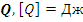 – мера изменения внутренней энергии, которую тело получает или отдает в результате теплообмена.
– мера изменения внутренней энергии, которую тело получает или отдает в результате теплообмена.
Замечание. В школьной программе базового уровня не рассматриваются формулы для вычисления количества теплоты через тепловые свойства газа.
Законы термодинамики:
1) Первый закон термодинамики – количество теплоты, которое получает газ, расходуется им на изменение внутренней энергии и совершение работы.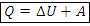 – первый закон термодинамики в формульной записи
– первый закон термодинамики в формульной записи
2) Второй закон термодинамики – не существует замкнутых процессов, единственным результатом которых будет передача тепла от более холодного тела к более теплому.
2. Первый закон термодинамики для изопроцессов
Частные случаи первого закона термодинамики для изопроцессов:
1) Изохорный: 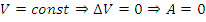
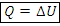
2) Изотермический: 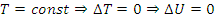
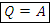
3) Изобарный: 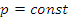
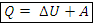
Определение. Адиабатный процесс – процесс, в котором не происходит теплообмен с окружающей средой: Q=0.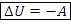 – первый закон термодинамики для адиабатного процесса
– первый закон термодинамики для адиабатного процесса
Замечание. Реальные процессы обычно считают адиабатными, если изменение состояния газа происходит очень быстро, то есть время мало и теплообменом с окружающей средой можно пренебречь.
Примеры адиабатных процессов:
1) Быстрое расширение газа, сопровождающееся охлаждением:
– такое расширение в огромных масштабах происходит в атмосфере Земли
– расширение сжиженного газа, который выходит из баллона или зажигалки

2) Быстрое сжатие газа, сопровождающееся нагреванием:

– принцип работы дизельного двигателя
– сжатие воздуха перед летящим метеоритом, снарядом, пулей и т.п.

Необратимость тепловых процессов. Все процессы самопроизвольно протекают в одном определенном направлении. Они не обратимы. Тепло всегда переходит от горячего тела к холодному, а механическая энергия тел - во внутреннюю энергию. Направление процессов в природе указывается вторым законом термодинамики.
Пример. Нагретые тела постепенно остывают, передавая свою энергию более холодным телам; колебания маятника постепенно затухают; подкинутый мяч со временем остановится, падающее яблоко останется лежать под деревом и т.д. Процессы, обратные перечисленным, нелепы.
Замечание. Обратный процесс передачи тепла от холодного тела к горячему не противоречит ЗСЭ, но противоречит второму началу термодинамики.
3. Определение работы газа и других термодинамических величин
по графикам процессов в газах
При работе с графиками газовый процессов удобно выбирать координаты  . Все правила будут рассмотрены на примере этих координат.
. Все правила будут рассмотрены на примере этих координат.
1) Работа газа A:
а) Для процесса работа равна площади фигуры под графиком, которая ограничена объемами газа: 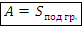
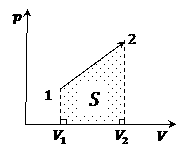
Замечание. Знак работы зависит от того расширяется газ или сжимается (см. конспект 15).
Замечание. Расчеты площади необходимо проводить, подставляя величины в соответствующем масштабе на осях, т.е. указанные на графике значения давлений и объемов.
б) Для цикла работа равна площади внутри графика: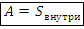
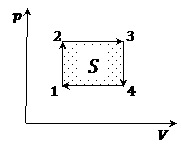
Замечание. Если направление цикла совпадает с ходом часовой стрелки, работа за цикл положительная; против хода часовой стрелки – отрицательная.
2) Изменение внутренней энергии ∆U рассчитывается по формулам через параметры  :
:
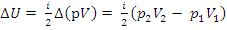
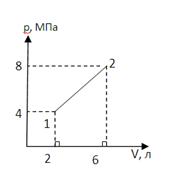
или по другим (см. конспект № 15)
Пример. Для одноатомного газа по приведенному графику процесса
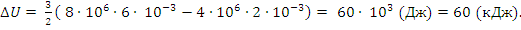
3) Количество теплоты Q рассчитывается по первому закону термодинамики: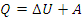
4. Тепловые машины
Определение. Тепловая машина – устройство для преобразования тепловой энергии в механическую работу (тепловой двигатель) или наоборот для передачи тепла от менее нагретого тела к более нагретому за счет выполнения работы (холодильная машина).
Примеры тепловых машин: двигатель внутреннего сгорания, паровой двигатель, холодильник и т.п.
Принципиальная схема тепловой машины: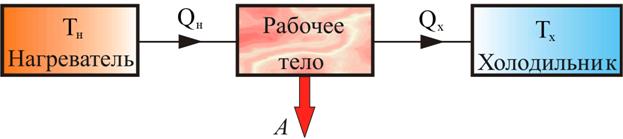
Принцип действия тепловых машин – организация взаимодействия между основными элементами машины для выполнения работы: нагреватель отдает рабочему телу (газ) количество теплоты  , выполняется работа
, выполняется работа 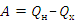 , где
, где  – количество теплоты отданное холодильнику.
– количество теплоты отданное холодильнику.
КПД тепловой машины, Дж: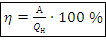
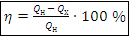
Замечание. Идеальная тепловая машина – эта такая тепловая машина, которая имеет максимально возможный КПД при данных температурах нагревателя  и холодильника
и холодильника  .
.
Цикл Карно – цикл работы идеальной тепловой машины, состоит из двух изотермических процессов и двух адиабатных.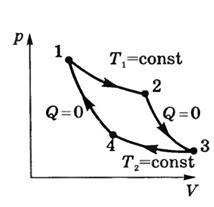
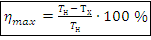 – КПД идеальной тепловой машины, Дж
– КПД идеальной тепловой машины, Дж
Тесты к уроку:
Онлайн-тест подготовки к ЗНО по физике №20 "Основы термодинамики"
Онлайн-тест подготовки к ЗНО по физике №21 "КПД тепловой машины. Графики процессов в термодинамике"
Полезные ссылки:
Опыт Дарлинга (пример тепловой машины)












