Онлайн-урок №10 "Введение в молекулярно-кинетическую теорию."
Онлайн-урок №10 "Введение в молекулярно-кинетическую теорию."
1.12.2015 о 18.30
Конспекты к уроку:
1. Введение в молекулярно-кинетическую теорию
Основные положения МКТ:
1) Все вещества состоят из мельчайших частиц: атомов и молекул;
2) Все частицы вещества находятся в непрерывном хаотичном движении;
3) Частицы вещества взаимодействуют силами притяжения и отталкивания.
Определение. Идеальный газ – модель реального газа, представляющая собой набор материальных точек, которые не взаимодействуют.
Замечание. Идеальный газ будет близок к реальному газу при низком давлении и высокой температуре.
Определение. Вакуум (технический) – газ при давлении намного более низком, чем атмосферное. Или состояние вещества, в котором длина свободного пробега частиц намного больше размеров сосуда (высокий вакуум).
Определение. Броуновское движение – беспорядочное видимое движение частиц твердого вещества, взвешенного в жидкости /газе, вызванное тепловым движением частиц жидкости/газа.
Определение. Диффузия – процесс взаимного проникновения частиц одного вещества, между частицами другого вещества, приводящий к естественному перемешиванию контактирующих веществ.
Замечание. Количество вещества (ν,[ν]=моль) – величина, характеризующая относительное количество частиц вещества.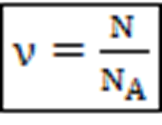 – количество вещества, моль
– количество вещества, моль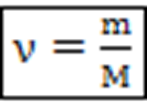 – количество вещества, моль
– количество вещества, моль
Где N – количество молекул в теле![]() – постоянная Авогадро (количество частиц в 1 моле вещества)
– постоянная Авогадро (количество частиц в 1 моле вещества)
m – масса тела, кг
М – молярная масса, т.е. масса одного моля вещества (табл. Менделеева), кг/моль
Замечание. Важно не забывать для записи молярной массы в СИ выполнять умножение относительной молекулярной массы из таблицы Менделеева на  . Например,
. Например, ![]() .
.
Замечание. В разных источниках могут быть указаны различные величины в качестве микро- и макропараметров газа.
Микропараметры газа (характеризуют частицы газа):
1) Масса частицы ![]() :
: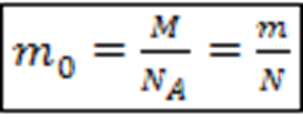
2) Средняя квадратичная скорость движения частицы ![]() .
.
3) Концентрация частиц ![]() :
:![]()
Где V – объем, в котором находится N частиц, м^3.
Макропараметры газа (характеризуют газ в целом):
1) Давление ![]() .
.
2) Объем ![]() .
.
3) Температура ![]() .
.
Замечание. Все значения температур в СИ измеряются в кельвинах, т.е. по шкале абсолютных температур. Абсолютный ноль температур равен -273,15°С и не достижим на практике.![]() – перевод между шкалами Цельсия и Кельвина, К
– перевод между шкалами Цельсия и Кельвина, К
Нормальные условия газа: Т = 273 К (0℃), ![]() .
.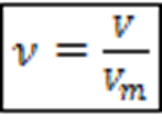 – количество вещества для газов при нормальных условиях, моль
– количество вещества для газов при нормальных условиях, моль
Где ![]() – молярный объем
– молярный объем
2. Основное уравнение МКТ
![]() – основное уравнение МКТ для идеального газа, Па
– основное уравнение МКТ для идеального газа, Па![]() – давление идеального газа, Па
– давление идеального газа, Па
Где ![]() – постоянная Больцмана
– постоянная Больцмана
Средняя кинетическая энергия поступательного движения частицы, Дж: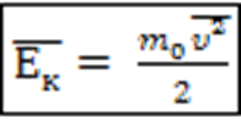
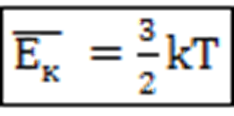
Давление и температура газов с точки зрения МКТ:
1) Температура – это мера средней тепловой энергии движения частицы вещества или мера активности движения частиц.
2) Давление газов характеризуется количеством соударений частиц с поверхностью в единицу времени и их средней кинетической энергией.
Тесты к уроку:
Онлайн-тест подготовки к ЗНО по физике №18 "Введение в молекулярно-кинетическую теорию. Основное уравнение МКТ"
Полезные ссылки:












