Онлайн-урок №7 "Оксиди. Основи"
Онлайн-урок "Розчини"
13.11.2015 о 18.30
Конспекти до уроку:
Классификация оксидов
По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды - это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную  , либо ионную кристаллическую решетку (твердые
, либо ионную кристаллическую решетку (твердые  или
или  ).
).
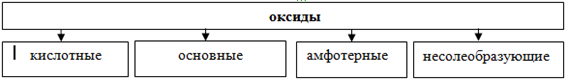
По кислотно-основным свойствам оксиды делятся на:
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
1. Основные оксиды.
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления.( ).
).
2. Кислотные оксиды.
Кислотные оксиды – это оксиды неметаллов ( ) и некоторых переходных металлов в высоких степенях окисления (
) и некоторых переходных металлов в высоких степенях окисления ( ).
).
3. Амфотерные оксиды.
К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
Это:  .
.
4. Несолеобразующие оксиды.
Несолеобразующие оксиды представлены в основном такими:  .
.
Физические свойства оксидов
Оксиды обладают физическими свойствами. Многие оксиды неметаллов при стандартных условиях газообразны  , оксиды азота. Есть жидкие оксиды. Это, например,
, оксиды азота. Есть жидкие оксиды. Это, например,  . Большинство оксидов металлов – твердые (
. Большинство оксидов металлов – твердые ( )
)
Оксиды бывают бесцветными ( ) или имеют окраску, например
) или имеют окраску, например  – бурый газ (лисий хвост).
– бурый газ (лисий хвост).

Химические свойства оксидов
1.Отношение к воде:
С водой реагируют оксиды щелочных и щелочноземельных металлов.( )
)


Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение  .
.


Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2.Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
Основные оксиды взаимодействуют с кислотами с образованием соли и воды.

Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.


Такая реакция может протекать, как в растворе, так и при сплавлении. При этом образуются различные продукты, в которой металл, образующий оксид находится в ионной форме.
Кислотные оксиды реагируют с основаниями, с образованием соли и воды.

Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.


Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.


2. При горении сложных веществ.


3. Термическое разложение некоторых сложных веществ.




Оксиды в природе
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов. Кварц и огромное количество его разновидностей. Массовая доля кварца и его разновидностей в земной коре составляет 60%.
Оксиды в природе.
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Диоксид циркония - чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии. Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.
Конспект 9. Основания
Классификация оснований
Гидроксиды – это электролиты, в результате диссоциации их водных растворов образуется толь один вид анионов: гидроксид анион  .
.
1. По растворимости в воде гидроксиды делятся на: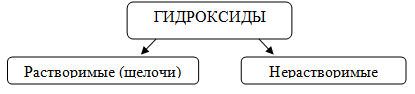
К растворимым гидроксидам относятся гидроксиды щелочных и щелочноземельных металлов.
Остальные гидроксиды относятся к нерастворимым.
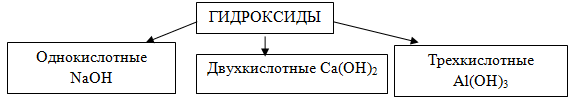
2. По количеству гидроксогрупп гидроксиды делятся на:
Физические свойства
Гидроксиды щелочных металлов при обычных условиях - это твердые белые вещества, гигроскопичны и очень хорошо растворимы в воде. При растворении в воде гидроксидов щелочных металлов происходит интенсивное выделение тепла. Поэтому при приготовлении их растворов нужно быть очень осторожным.
Гидроксиды щелочноземельных металлов – это также белые кристаллические вещества, но менее растворимые в воде, чем гидроксиды щелочных металлов.
Амфотерные гидроксиды в основном образуются в виде студенистых гелеобразных осадков при прибавлении растворов щелочей к растворимым солям соответствующих металлов.
Химические свойства
1. Реакция с кислотами.
Все гидроксиды реагируют с кислотами с образованием соли и воды.
Реакция сильных гидроксидов с сильными кислотами называется реакцией нейтрализации.

2. Реакция с кислотными оксидами.
3. Реакция с солями. Щелочи реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок, поскольку образование нерастворимых соединений смещает равновесие вправо и делает её практически необратимой. ↓
↓ ↓
↓
4. Разложение при нагревании. Нерастворимые гидроксиды при нагревании разлагаются на соответствующий оксид и воду.

Этот процесс происходит медленно и без нагревания при хранении оксидов в безводной среде.
5. Обнаружение щелочей при помощи кислотно-основных индикаторов.
В щелочной среде лакмус приобретает синюю окраску. Метиловый оранжевый – желтую, а фенолфталеиновый – малиновый.

Основные способы получения гидроксидов
1. Щелочи можно получить при взаимодействии соответствующих металлов с водой.
Взаимодействие калия и цезия с водой.



Активность щелочных металлов возрастает с увеличением их молярной массы. Взаимодействие цезия с водой происходит уже со взрывом.
2. Щелочи можно получить при взаимодействии оксидов щелочных и щелочноземельных металлов с водой.
3. Электролиз растворов солей металлов I-A и II-A группы. ↑+
↑+  ↑
↑
4. Нерастворимые и амфотерные гидроксиды получают в основном обменными реакциями солей соответствующего металла со щелочью. ↓
↓
Некоторые сложности наблюдаются при получении амфотерных гидроксидов, ↓
↓
Так как полученный осадок при добавлении щелочи образует растворимые гидроксокомплексы.![NaOH + Al(OH)_3 = NaNO_3 + Na{[}Al(OH)4{]} NaOH + Al(OH)_3 = NaNO_3 + Na{[}Al(OH)4{]}](/plugins/content/MathPublisher/mathpublisher/img/math_977.5_31479004c5f6761bd0d35a6cbde78b2e.png)
Нужно контролировать количество добавляемой щелочи или использовать другие реагенты. Например, при взаимодействии с гидроксидом аммония получается осадок  ↓, который даже не растворяется в избытке гидроксида аммония.
↓, который даже не растворяется в избытке гидроксида аммония. ↓
↓
5. Нерастворимы гидроксиды можно получить при необратимом гидролизе некоторых солей. ↓ +
↓ +  ↑
↑ 
Применение щелочей
Встретиться со щелочами можно и в быту. Гидроксид натрия используется в качестве агента при растворении засора в трубах. Применяется он в виде сухих гранул, или в виде раствора. Средство для прочистки труб «Крот» - это подкрашенный раствор гидроксида натрия. Щелочь вызывает растворимость органических соединений, содержащихся в засоре. Способствует его разрушению. Гидроксид натрия иногда применяется даже в пищевой промышленности. В России он зарегистрирован в качестве пищевой добавки Е-524.некоторые традиционные блюда готовятся с применением этого вещества. Например, это скандинавское блюдо из рыбы под названием Лютефиск.
Для его приготовления сушеная треска вымачивается 5-6 дней в щелочи и приобретает из-за этого мягкую желеобразную консистенцию.
Малорастворимые гидроксиды алюминия и магния применяются для лечения изжоги. Они нейтрализуют избыток соляной кислоты при повышенной кислотности желудочного сока. Таким образом, уменьшая его вредное действие на слизистую желудка. Важно, что избыток гидроксидов не вредит организму, так как они нерастворимы, то они просто выводятся из организма. Известный препарат «Альмагель» – это почти целиком гель гидроксида алюминия с небольшой добавкой гидроксида магния, а «Маалокс» – это смесь гидроксидов алюминия и магния в одинаковом соотношении по массе.
Тести до уроку:
Онлайн-тест подготовки к ЗНО по химии№10 "Оксиды"
Онлайн-тест подготовки к ЗНО по химии №11 "Классы неорганических соединений. Основания"
Корисні посилання: